题目内容
2.某无色溶液中只含有下列7种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-,已知该溶液与铝反应放出氢气.试回答下列问题:(1)若反应后生成Al3+,反应的离子方程式为2Al+6H+=2Al3++3H2↑;则原溶液中一定存在的离子有H+、Cl-,一定不存在的离子有Ag+、OH-、HCO3-、NO3-.
(2)若反应后生成AlO${\;}_{2}^{-}$离子,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;则原溶液中一定存在的离子有Na+、OH-,一定不存在的离子有Mg2+、H+、Ag+、HCO3-.
分析 跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成AlO2-时,溶液为碱溶液,然后利用离子的共存来分析,并注意离子在水中的颜色.
解答 解:离子均为无色,所有离子均与无色透明溶液符合;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)溶液和铝粉反应后有Al3+生成,离子反应方程式为:2Al+6H+=2Al3++3H2↑,溶液显酸性,则HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,根据溶液不显电性,一定存在阴离子,即溶液中肯定有Cl-,而Ag+可与Cl-生成沉淀,说明原溶液中也不存在Ag+,即溶液中一定含有大量的H+、Cl-,可能含Na+、Mg2+,一定不能含有:Ag+、OH-、HCO3-、NO3-,
故答案为:2Al+6H+=2Al3++3H2↑;H+、Cl-;Ag+、OH-、HCO3-、NO3-;
(2)溶液和铝粉反应后有AlO2-生成,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,溶液显碱性时,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含NO3-、Cl-,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Na+、OH-;Mg2+、H+、Ag+、HCO3-.
点评 本题考查常见离子的检验,为高频考点,把握溶液酸碱性判断、发生的离子反应、离子共存为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
18.以下表示氦原子结构的化学用语中,对电子运动状态描述最详细的是( )
| A. | :He | B. |  | C. | 1s2 | D. |  |
3.含等物质的量浓度的Na2S和NaBr的溶液中缓慢通入氯气,下列离子方程式不符合实际情况的是( )
| A. | S2-+Cl2═S↓+2Cl- | B. | S2-+2Br-+2Cl2═S↓+Br2+4Cl- | ||
| C. | 2S2-+2Br-+3Cl2═2S↓+Br2+6Cl- | D. | 3S2-+2Br-+4Cl2═3S↓+Br2+8Cl- |
14.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题: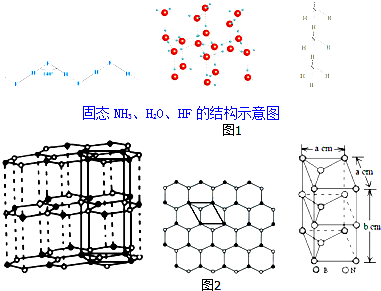
(1)基态Cu2+的电子排布式为1s22s22p63s23p63d9,其最外电子层的电子数为17.
(2)利用价层电子对互斥理论(VSEPR theory)预测多原子分子或离子立体构型时,认为价层电子间互斥力(F)的大小决定了夹角(∠)的大小:F(孤电子对间)>F(孤电子对-双键电子)>F(双键电子-单键电子)>F(单键电子间),则a.∠(孤-孤夹角)、b.∠(孤-双夹角)、c.∠(双-单夹角)、d.∠(单-单夹角)由大到小的排序为abcd(填编号);XeF4中Xe价层电子数为6对,画出其VSEPR模型(含中心原子的孤电子对)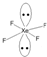 .
.
(3)在图1中,除NH3、H2O、HF外的同主族氢化物的沸点随周期数增大而升高的原因是同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大;
已知固态NH3、H2O、HF的氢键键能和结构如表:
根据如表固态NH3、H2O、HF的结构示意图解释H2O、HF、NH3沸点依次降低的原因:单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(4)石墨型BN呈白色,亦称“白石墨”,“白石墨”在一定条件下可转化为金刚石型BN.“白石墨”的结构示意图和晶胞如图2(中图是晶胞底面从“白石墨”中的截取情况),则“白石墨”的密度为$\frac{100}{\sqrt{3}{N}_{A}{a}^{2}b}$g•cm-3(以含a、b的代数式表示).

(1)基态Cu2+的电子排布式为1s22s22p63s23p63d9,其最外电子层的电子数为17.
(2)利用价层电子对互斥理论(VSEPR theory)预测多原子分子或离子立体构型时,认为价层电子间互斥力(F)的大小决定了夹角(∠)的大小:F(孤电子对间)>F(孤电子对-双键电子)>F(双键电子-单键电子)>F(单键电子间),则a.∠(孤-孤夹角)、b.∠(孤-双夹角)、c.∠(双-单夹角)、d.∠(单-单夹角)由大到小的排序为abcd(填编号);XeF4中Xe价层电子数为6对,画出其VSEPR模型(含中心原子的孤电子对)
 .
.(3)在图1中,除NH3、H2O、HF外的同主族氢化物的沸点随周期数增大而升高的原因是同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大;
已知固态NH3、H2O、HF的氢键键能和结构如表:
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
(4)石墨型BN呈白色,亦称“白石墨”,“白石墨”在一定条件下可转化为金刚石型BN.“白石墨”的结构示意图和晶胞如图2(中图是晶胞底面从“白石墨”中的截取情况),则“白石墨”的密度为$\frac{100}{\sqrt{3}{N}_{A}{a}^{2}b}$g•cm-3(以含a、b的代数式表示).
11.1g H2的热值为142.9KJ热量,下列反应的热化学方程式正确的是( )
| A. | H2+O2═2H2O△H=-571.6KJ/mol | |
| B. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-142.9KJ/mol | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6KJ/mol |
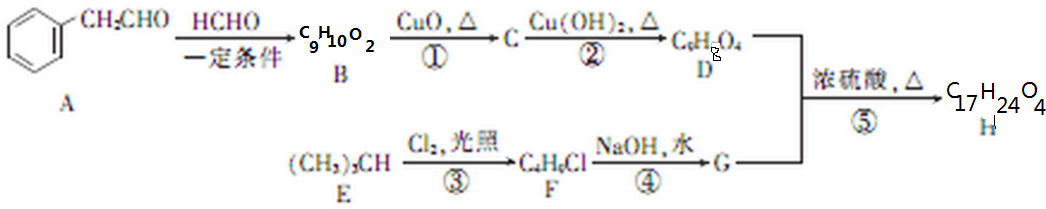
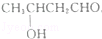
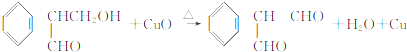
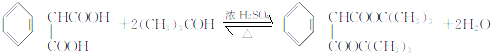
 (不考虑立体异构)?
(不考虑立体异构)?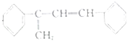 的合成路线.
的合成路线.