题目内容
18.硫酸镁在药疗上常用作导泻剂.硫酸镁(MgSO4)属于( )| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
分析 水溶液中电离出的阳离子全部是氢离子的化合物为酸,
水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱,
金属阳离子包括铵根离子和酸根阴离子构成的化合物为盐,
两种元素组成其中一种为氧元素的化合物为氧化物.
解答 解:硫酸镁(MgSO4)是镁离子和硫酸根离子构成的化合物属于盐,故选C.
点评 本题考查了物质分类、物质组成的分析判断,主要是概念实质的理解应用,题目较简单.

练习册系列答案
相关题目
8.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算出某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
9.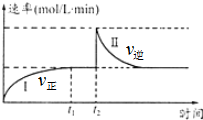 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(| A. | 0~t2时,v正>v逆 | |
| B. | t2时刻改变的条件可能是加催化剂 | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
13.甲、乙是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+乙+H2O--HRO3+HZ(未配平).下列说法不正确的是( )
| A. | R原子最外层电子数为5 | B. | 单质的氧化性:甲<乙 | ||
| C. | 原子半径:R>Z | D. | HRO3与HZ计量数之比为1:5 |
3.用nA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,44 g CO2气体中含有的碳原子数为nA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5nA | |
| C. | 1 mol铁与足量的稀硫酸完全反应转移的电子数为3nA | |
| D. | 1 L 1 mol•L-1 CuCl2溶液中含有的氯离子数为nA |
7.下列化学用语表示正确的是( )
| A. | 乙醇的结构简式:C2H6O | |
| B. | 硫离子的结构示意图: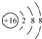 | |
| C. | 氮气的电子式: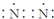 | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1mol C4H10分子中共价键总数为13NA | |
| C. | 1 mol甲基所含的电子总数为7NA | |
| D. | 标准状况下,11.2 L己烷所含分子数为0.5 NA |
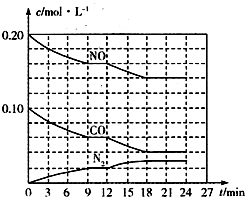 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.