题目内容
3.用nA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,44 g CO2气体中含有的碳原子数为nA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5nA | |
| C. | 1 mol铁与足量的稀硫酸完全反应转移的电子数为3nA | |
| D. | 1 L 1 mol•L-1 CuCl2溶液中含有的氯离子数为nA |
分析 A、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含1mol碳原子来分析;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、铁和稀硫酸反应后变为+2价;
D、求出氯化铜的物质的量,然后根据1mol氯化铜中含2mol氯离子来分析.
解答 解:A、44g二氧化碳的物质的量为1mol,而1mol二氧化碳中含1mol碳原子即nA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故11.2LHCl的物质的量小于0.5mol,故分子个数小于0.5nA个,故B错误;
C、铁和稀硫酸反应后变为+2价,故1mol铁失去2mol即2nA个电子,故C错误;
D、溶液中氯化铜的物质的量为n=CV=1mol/L×1L=1mol,而1mol氯化铜中含2mol氯离子,即含2nA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.表示下列操作的离子方程式正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-→CH3COO-+NH4++3NH3+2Aɡ↓+H2O | |
| C. | 向沸水中滴加FeCl3溶液制备胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | 将Cl2溶于水中:Cl2+H2O═Cl-+2H++ClO- |
11.下列图象表达正确的是( )
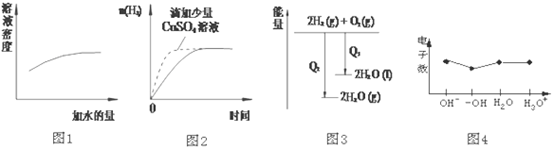

| A. | 图1表示浓硫酸的稀释 | |
| B. | 图2表示过量的盐酸与等量的锌粉反应 | |
| C. | 图3表示氢气与氧气反应中的能量变化 | |
| D. | 图4表示微粒电子数 |
18.硫酸镁在药疗上常用作导泻剂.硫酸镁(MgSO4)属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
12.下列有关物质的区分方法不正确的是( )
| A. | 用丁达尔效应区分淀粉溶液和食盐水 | |
| B. | 用品红溶液区分SO2与CO2气体 | |
| C. | 用石蕊试液区分KOH溶液与NaOH溶液 | |
| D. | 用碘水区分淀粉溶液与蛋白质溶液 |
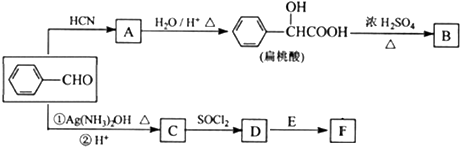

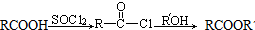 (R、Rˊ代表烃基)
(R、Rˊ代表烃基)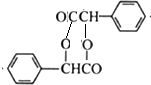 ,化合物C中的含氧官能团的名称是羧基.
,化合物C中的含氧官能团的名称是羧基. .
.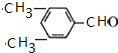 .
. 短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题:
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题: ,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).
,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).