题目内容
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1mol C4H10分子中共价键总数为13NA | |
| C. | 1 mol甲基所含的电子总数为7NA | |
| D. | 标准状况下,11.2 L己烷所含分子数为0.5 NA |
分析 A、求出乙烯的物质的量,然后根据1mol乙烯中含6mol共用电子对来分析;
B、C4H10中含10条C-H键和3条C-C键;
C、甲基不显电性;
D、标况下己烷为液态.
解答 解:A、28g乙烯的物质的量为1mol,而1mol乙烯中含6mol共用电子对,即含6NA个,故A错误;
B、C4H10中含10条C-H键和3条C-C键,故1molC4H10中含13mol共价键即13NA个,故B正确;
C、甲基不显电性,故1mol甲基含9mol电子即9NA个,故C错误;
D、标况下己烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.硫酸镁在药疗上常用作导泻剂.硫酸镁(MgSO4)属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
16.“基因剪刀”(酶)的合成和克隆,为化学治疗提供了一种全新的观念和途径.实验室在适宜的条件下,用含有过氧化氢酶的猪肝研磨液催化过氧化氢分解,比用FeCl3溶液催化过氧化氢分解的速率快得多,这说明与无机催化剂相比,酶具有的特性是( )
| A. | 专一性 | B. | 多样性 | C. | 高效性 | D. | 适应性 |
3.取少量无机盐溶液试样对其中的离子进行检验.下列判断正确的是( )
| A. | 加入盐酸,产生白色沉淀,则试样中一定有Ag+ | |
| B. | 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-或HCO3- | |
| C. | 加入NaOH溶液微热,产生使湿润红色石蕊试纸变蓝气体,则试样中一定有NH4+ | |
| D. | 加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则试样中一定有SO42- |
20.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
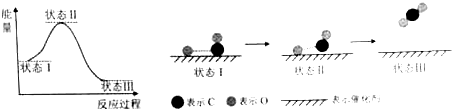
下列说法中正确的是( )

下列说法中正确的是( )
| A. | CO和O生成CO2是吸热反应 | B. | 在该过程中,CO断键形成C和O | ||
| C. | CO和O生成了具有极性共价键的CO2 | D. | 催化剂可改变该反应的焓变 |
17. 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2O(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡,c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) |

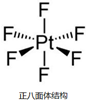 Ⅰ.一定条件下,O2可通过得失电子转化为O2-、O2+ 和O22-.
Ⅰ.一定条件下,O2可通过得失电子转化为O2-、O2+ 和O22-.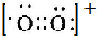 .
.