题目内容
10. 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
已知:①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ•mol-1
②C和C0的燃烧热(△H)分别为-393.5kJ•mol-1和-283kJ•mol-1
则2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5kJ•mol-1
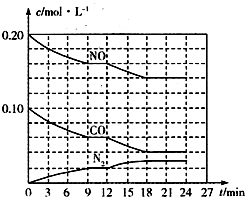
(2)将0.20mol NO和0.10mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示.
①CO在0-9min内的平均反应速率v(C0)=4.4×10-3mol.L-1min-1(保留两位有效数字);第12min时改变的反应条件可能为D.
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24min时达到平衡状态,CO2的体积分数为22.2%(保留三位有效数字),化学平衡常数K=3.4(保留两位有效数字).
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2.已知常温下0.1mol/L的HCOONa溶液pH=10,则HCOOH的电离常数Ka=1.0×10-7.
分析 (1)写出C和CO燃烧热的热化学方程式,结合盖斯定律计算所需要的热化学方程式;
(2)①分析图象浓度变化,结合反应速率概念计算V=$\frac{△c}{△t}$得到,第12min时一氧化碳和一氧化氮减小,氮气浓度增大,说明平衡正向进行,依据化学平衡移动原理分析判断选项对平衡的影响;
②依据图象分析判断,平衡状态时一氧化碳一氧化氮和氮气浓度,结合化学平衡三段式列式计算平衡百分含量和平衡常数;
(3)依据溶液中存在的电荷守恒分析;
(4)计算水解平衡常数Kh,再根据Ka=$\frac{{K}_{w}}{{K}_{h}}$计算.
解答 解:解:(1)①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ•mol-1
②C的燃烧热(△H)为-393.5kJ•mol-1,热化学方程式为C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
③C0的燃烧热283kJ•mol-1 ,热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1;
依据盖斯定律计算③×2-①得到,2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5KJ/mol
故答案为:-746.5;
(2)①图象分析一氧化碳浓度变化=0.10mol/L-0.06mol/L=0.04mol/L,CO在0-9min内的平均反应速率v(CO)=$\frac{0.04mol/L}{9min}$=4.4×10-3mol/(L.min),第12min时,一氧化碳和一氧化氮浓度减小,浓度增大说明平衡正向进行;
A.反应是放热反应,升高温度,平衡逆向进行,故A不符合;
B.加入NO,平衡正向进行,一氧化氮浓度大于原平衡,故B不符合;
C.加催化剂改变反应速率不改变化学平衡,故C不符合;
D.反应是放热反应,降低温度,平衡正向进行,故D符合;
改变的反应条件可能是降低温度;
故答案为:4.4×10-3;D;
②该反应在第24min时达到平衡状态,平衡浓度c(N2)=0.03mol/L,c(NO)=0.14mol/L,c(CO)=0.04mol/L,依据化学平衡三段式列式计算
2NO(g)+2CO(g)═N2(g)+2CO2(g)
起始量(mol/L) 0.2 0.1 0 0
变化量(mol/L) 0.06 0.06 0.03 0.06
平衡量(mol/L) 0.14 0.04 0.03 0.06
CO2的体积分数=$\frac{0.06}{0.14+0.04+0.03+0.06}$×100%=22.2%
平衡常数K=$\frac{(0.06)^{2}×0.03}{(0.14)^{2}×(0.04)^{2}}$=3.4
故答案为:22.2%;3.4;
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-),故答案为:2c(SO32-)+c(HSO3-);
(4)常温下,0.1mol/L的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O?HCOOH+OH-,故Kh=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1-1{0}^{-4}}$=10-7,则HCOOH的电离常数Ka=$\frac{{K}_{w}}{{K}_{h}}$=$\frac{1{0}^{-14}}{1{0}^{-7}}$=1×10-7,故答案为:1.0×10-7.
点评 本题考查化学平衡计算、化学平衡影响因素、盐类水解、盖斯定律等知识点,为高频考点,侧重考查学生分析判断及计算能力,会根据曲线变化趋势分析图象,难点是(4)题计算,题目难度中等.

| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 在清洗地板时,84消毒液和洁厕灵(主要成分是盐酸)不能混合使用 |
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
| A. |  分离水和酒精 | |
| B. |  蒸发NH4Cl溶液得到NH4Cl晶体 | |
| C. |  配制一定物质的量浓度溶液时转移溶液 | |
| D. |  除去氯气中的氯化氢 |
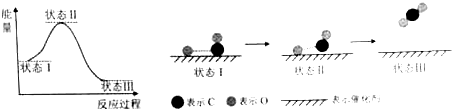
下列说法中正确的是( )
| A. | CO和O生成CO2是吸热反应 | B. | 在该过程中,CO断键形成C和O | ||
| C. | CO和O生成了具有极性共价键的CO2 | D. | 催化剂可改变该反应的焓变 |
 短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题:
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题: ,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).
,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).