题目内容
20.获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,相关论文发表在J.Am.Chem.Soc.(128,8720~8721,2006)上,已知电池总反应式为2Al+3I2═2AlI3.下列说法不正确的是( )| A. | 该电池负极的电极反应为:Al-3e-═Al3+ | |
| B. | 该电池可能是一种可充电的二次电池 | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 | |
| D. | 电池工作时,溶液中铝离子向正极移动 |
分析 由电池总反应为2Al+3I2═2AlI3,Al元素的化合价升高、I元素的化合价降低,则Al为负极,发生氧化反应,阳离子向正极移动,根据等物质的量的金属失去电子的物质的量多少计算比较,以此来解答.
解答 解:A.因Al元素的化合价升高,则电池负极的电极反应为Al-3e-═Al3+,故A正确;
B.该电池属于一次电池,不能充电,故B错误;
C.因Al的摩尔质量为27g/mol,由$\frac{m}{M}$×失去的电子数可知,消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多,故C正确;
D.原电池中阳离子向正极移动,则电池工作时,溶液中的铝离子向正极移动,故D正确;
故选B.
点评 本题考查化学电源新型电池,注意发生的电池反应与氧化还原反应的关系即可解答,明确发生的电极反应及原电池工作原理来解答,题目难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1 mo1/L盐酸中含1 mo1HCl分子 | |
| C. | 在标准状况下,22.4 LCH4与18gH2O所含有的分子数均为NA | |
| D. | 22.4L的CO气体与1mol N2所含的电子数一定相等 |
11.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,可由下列反应制得:2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;一定条件\;}}{\;}$2K2FeO4+6KCl+8H2O下列关于该反应说法正确的是( )
| A. | KOH是氧化剂 | |
| B. | Cl2发生还原反应 | |
| C. | Fe(OH)3是还原剂 | |
| D. | 生成1 mol K2FeO4转移6 mol的电子 |
15.用1.000mol/LNaOH溶液滴定0.100mol/LH2SeO3溶液,在下图曲线标注位置,下面什么物质含硒量最少占溶液中硒总量的10%.( )
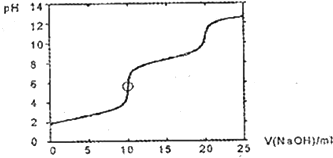

| A. | H2SeO3 | B. | H2SeO3和HSeO3- | C. | HSeO3- | D. | HSeO3-和SeO32- |
5.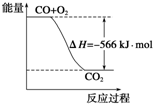 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283 kJ | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-532 kJ•mol-1 | |
| D. | CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023 |
12.下列物质在溶液中电离出的Cl-与1mol CaCl2电离出的Cl-数目相同的是( )
| A. | 2 mol KClO3 | B. | 1 mol KCl | C. | 2 mol MgCl2 | D. | 2 mol NaCl |
14.可逆反应FeCl3+3KSCN?Fe(SCN)3+3KCl达到化学平衡后,加人少量的水,平衡的移动情况为( )
| A. | 不移动 | B. | 平衡左移 | C. | 平衡右移 | D. | 无法确定 |
 .Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
.Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.