题目内容
12.下列物质在溶液中电离出的Cl-与1mol CaCl2电离出的Cl-数目相同的是( )| A. | 2 mol KClO3 | B. | 1 mol KCl | C. | 2 mol MgCl2 | D. | 2 mol NaCl |
分析 电解质溶液中离子物质的量=电解质物质的量×化学式中离子数目.
解答 解:1mol CaCl2电离出的Cl-物质的量为1mol×2=2mol.
A.KClO3电离得到钾离子与氯酸根离子,没有氯离子,故A错误;
B.1 mol KCl电离出的Cl-物质的量为1mol×1=1mol,故B错误;
C.2 mol MgCl2电离出的Cl-物质的量为2mol×2=4mol,故C错误;
D.2 mol NaCl电离出的Cl-物质的量为2mol×1=2mol,故D正确,
故选:D.
点评 本题考查物质的量有关计算,比较基础,注意根据电离方程式理解化学式与离子物质的量关系.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.可逆反应:3A?3B+C△H>0,已知反应物A为气态物质,随着温度的升高,反应体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是( )
①若C为固体,则B一定是气体 ②B和C一定都是气体
③B和C可能都是固体 ④B和C可能都是气体.
①若C为固体,则B一定是气体 ②B和C一定都是气体
③B和C可能都是固体 ④B和C可能都是气体.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
20.获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,相关论文发表在J.Am.Chem.Soc.(128,8720~8721,2006)上,已知电池总反应式为2Al+3I2═2AlI3.下列说法不正确的是( )
| A. | 该电池负极的电极反应为:Al-3e-═Al3+ | |
| B. | 该电池可能是一种可充电的二次电池 | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 | |
| D. | 电池工作时,溶液中铝离子向正极移动 |
7.下列关于溶液和胶体的叙述正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 胶体粒子可以通过半透膜而溶液不行,故可以用半透膜来分离胶体和溶液 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
17.在含2molH2SO4的浓硫酸中加入足量的锌粉,使其充分反应,下列推断中错误的是( )
①放出的气体除SO2外还有H2 ②只放出1molSO2气体 ③反应结束时转移4mol电子.
①放出的气体除SO2外还有H2 ②只放出1molSO2气体 ③反应结束时转移4mol电子.
| A. | ① | B. | ② | C. | ②③ | D. | ①② |
4.下列物质的溶液中分别滴加Ba(OH)2溶液至过量,反应产生的沉淀的质量(m)或物质的量(n)随加入的Ba(OH)2溶液体积关系图象正确的是( )
| A. | 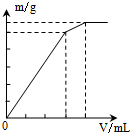 Al2(SO4)2 | B. | 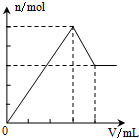 KAl(SO4)2 | C. | 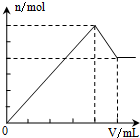 NH4Al(SO4)2 | D. | 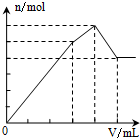 NH4Al(SO4)2 |
1.已知:Na2SO3+H2O+I2=Na2SO4+2HI.现有一无色溶液,可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含Cu2+;②肯定不含I-;③肯定含有SO32-;④可能含有I-.
①肯定不含Cu2+;②肯定不含I-;③肯定含有SO32-;④可能含有I-.
| A. | ①③ | B. | ①③④ | C. | ①② | D. | ②③④ |
6.某原电池结构如图所示,下列有关该原电池的说法正确的是( )
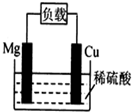

| A. | 电池反应为:Mg+2H+=Mg2++H2↑ | B. | 镁棒发生还原反应 | ||
| C. | 电子从铜棒经外电路流向镁棒 | D. | 铜棒为负极 |