题目内容
14.将铁与氧化铁的混合物15克,加入150mL稀硫酸中,标况下放出氢气1.68升,同时铁和氧化铁均无剩余,向溶液中滴加KSCN溶液,未见颜色变化.(1)混合物中铁的质量为7g.
(2)为使Fe2完全转化为Fe(OH)2,共消耗3mol•L-1的氢氧化钠溶液200mL,则原硫酸的物质的量浓度为2mol/L.
分析 (1)向溶液中滴入KSCN溶液,未见颜色变化,说明硫酸过量,反应后溶液中铁元素完全转化成亚铁离子,据此写出反应的化学方程式;根据反应方程式计算出混合物中单质铁的质量;
(2)将Fe2完全转化为Fe(OH)2,此时溶质为硫酸钠,根据质量守恒计算出原硫酸的物质的量浓度.
解答 解:(1)由题意可知,反应后的溶液中Fe元素的存在形式为Fe2+,
故发生反应有:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe+Fe2(SO4)3=3FeSO4、Fe+H2SO4=FeSO4+H2↑,
生成氢气的物质的量为:n(H2)=$\frac{1.68L}{22.4L/mol}$=0.075mol,
与H2SO4反应的铁的物质的量为:n(Fe)=n(H2)=0.075mol,
综合前两个反应方程式可知:与Fe2(SO4)3反应的铁为 n(Fe)ˊ=n[Fe2(SO4)3]=n(Fe2O3),
铁与氧化铁的总质量为15g,则:(n(Fe)ˊ+0.075mol)×56g/mol+n(Fe)ˊ×160g/mol=15g,
解得:n(Fe)ˊ=0.05mol,
混合物中铁的物质的量为:n(Fe)=0.075mol+0.05mol=0.125mol,
所以混合物中铁的质量为:m(Fe)=0.125mol×56g/mol=7g,
故答案为:7;
(2)中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,反应后的溶液中溶质为Na2SO4,
则:n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×3mol/L×0.2L=0.3mol,
原硫酸的浓度为:c(H2SO4)=$\frac{0.3mol}{0.15L}$=2mol/L,
故答案为:2mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,根据题干信息正确判断发生反应为解答关键,注意质量守恒在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.

是( )
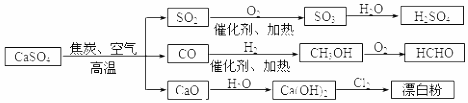
| A. | CO、SO2均为无色有刺激性气味的有毒气体 | |
| B. | 工业上利用Cl2 和澄清石灰水反应来制取漂白粉 | |
| C. | 除去与水反应,图示转化反应均为氧化还原反应 | |
| D. | 用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
CH3OH (l)+$\frac{3}{2}$ O2(g)=CO2(g)+2H2O(l)△H=-726.5KJ/mol.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)?2NH3(g)△H=a kJ•mol-1.有关键能数据如表:
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:
△H=+226.7 KJ/mol.
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示
意图如图:

第一步反应是放热反应(填“放热”或“吸热”),原因是反应物总能量高于生成物总能量.