题目内容
19.将2.4克镁投入500mL 1mol/L盐酸中,试计算(请按照解题步骤写出详细解答过程):(1)标准状况下,生成H2的体积.
(2)若反应完成后,溶液体积仍为500mL,此时溶液中的Mg2+ 和H+的物质的量浓度分别是多少?
分析 2.4g镁的物质的量n=$\frac{2.4g}{24g/mol}$=0.1mol,500mL 1mol/L盐酸中HCl的物质的量n=CV=1mol/L×0.5L=0.5mol.根据化学方程式Mg+2HCl=ZnCl2+H2↑可知,0.1mol镁反应消耗0.2mol盐酸,故盐酸过量.
(1)由于盐酸过量,故根据镁的量来计算生成的氢气的量.设生成的氢气为xmol,则有Mg+2HCl=MgCl2+H2↑
1 1
0.1mol xmol
故有:$\frac{1}{0.1mol}=\frac{1}{xmol}$,据此解答;
(2)设反应中生成的镁离子的物质的量为ymol,消耗的氢离子的物质的量为zmol,则有:
Mg+2HCl=MgCl2+H2↑
1 2 1
0.1mol zmol ymol
则有:$\frac{1}{0.1mol}=\frac{2}{zmol}=\frac{1}{ymol}$,据此解答.
解答 解:2.4g镁的物质的量n=$\frac{2.4g}{24g/mol}$=0.1mol,500mL 1mol/L盐酸中HCl的物质的量n=CV=1mol/L×0.5L=0.5mol.根据化学方程式Mg+2HCl=ZnCl2+H2↑可知,0.1mol镁反应消耗0.2mol盐酸,故盐酸过量.
(1)由于盐酸过量,故根据镁的量来计算生成的氢气的量.设生成的氢气为xmol,则有Mg+2HCl=MgCl2+H2↑
1 1
0.1mol xmol
故有:$\frac{1}{0.1mol}=\frac{1}{xmol}$,解得x=0.1mol,
在标况下的体积V=nVm=0.1mol×22.4L/mol=2.24L
答:生成的氢气在标况下为2.24L.
(2)反应中生成的镁离子的物质的量为ymol,消耗的氢离子的物质的量为zmol,则有:
Mg+2HCl=MgCl2+H2↑
1 2 1
0.1mol zmol ymol
则有:$\frac{1}{0.1mol}=\frac{2}{zmol}=\frac{1}{ymol}$.
解得y=0.1mol,z=0.2mol
即溶液中镁离子的物质的量为0.1mol,而氢离子的物质的量n=0.5mol-0.2mol=0.3mol
故溶液中镁离子的物质的量浓度c=$\frac{0.1mol}{0.5L}$=0.2mol/L;
溶液中氢离子的物质的量浓度c=$\frac{0.3mol}{0.5L}$=0.6mol/L.
答:所得溶液中镁离子的浓度为0.2mol/L,氢离子浓度为0.6mol/L.
点评 本题考查了有关化学方程式的计算,难度不大,应注意根据化学方程式计算是的原则是”上下一致,左右相当“.

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案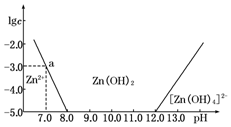
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=1.00×10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁.
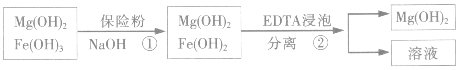
(4)步骤①中加入保险粉(Na2S2O4)的作用:将氢氧化铁还原为氢氧化亚铁
(5)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应.虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2.请从沉淀溶解平衡的角度加以解释Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解;;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如表:
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
①40℃②60℃③EDTA质量为O.05g ④EDTA质量为0.10g ⑤保险粉质量为0.05g⑥保险粉质量为0.10g
A.①③⑤B.②④⑥C.①④⑥D.②③
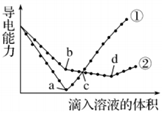
| A. | b点,水电离产生的c(H+)<10-7mol/L | B. | ①代表滴加H2SO4溶液的变化曲线 | ||
| C. | a、d两点对应的溶液均显中性 | D. | c点,两溶液中含有相同量的 OH- |
| A. | H2在Cl2中燃烧 | B. | 酸碱中和反应 | ||
| C. | 液态水变成水蒸气 | D. | 浓硫酸稀释 |
| A. | 丙烯 | B. | 1-丁烯 | C. | 2-甲基-2-戊烯 | D. | 2-己烯 |
| A. | 次氯酸钙的化学式:CaClO2 | |
| B. | 作为相对原子质量标准的碳原子可表示为:126C | |
| C. | 钠原子的结构示意图: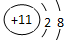 | |
| D. | 硫酸的电离方程式:H2SO4═H++SO42- |

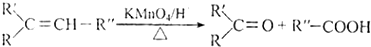
 .
. .
.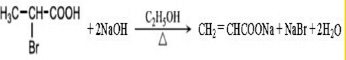 .
.