题目内容
9.将下列物质分类,并用序号填空.①氢气②硫磺③二氧化硫④液氧⑤氧化镁 ⑥矿泉水 ⑦空气 ⑧四氧化三铁⑨石灰水⑩铜丝
混合物有⑥⑦⑨;纯净物有①②③④⑤⑧⑩;化合物有③⑤⑧;氧化物有③⑤⑧;金属单质有⑩;非金属单质有①②④.
分析 物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;
纯净物是由一种物质组成,纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物;
氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素;
金属元素组成的单质为金属单质,非金属元素组成的单质为非金属单质.
解答 解:物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成,⑥矿泉水、⑦空气、⑨石灰水都属于混合物;
纯净物是由一种物质组成,①氢气、②硫磺、③二氧化碳、④液氧、⑤氧化镁、⑧四氧化三铁、⑩铜丝都属于纯净物;
纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物,③二氧化碳、⑤氧化镁、⑧四氧化三铁都属于化合物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,③二氧化碳、⑤氧化镁、⑧四氧化三铁都属于氧化物;
⑩铜丝属于金属单质,①氢气、②硫磺、④液氧属于非金属单质.
故答案为:⑥⑦⑨;①②③④⑤⑧⑩;③⑤⑧;③⑤⑧;⑩;①②④.
点评 本考点考查了物质的分类,物质的分类是历届中考的重点,学生在进行辨别时,往往误以元素种类的多少进行混合物与纯净物的判断,或者忽略了单质、化合物必须是纯净物这一大前提.本考点的基础性比较强,主要出现在选择题和填空题中,题目难度不大.

练习册系列答案
相关题目
2.根据下列信息试回答下列问题
(Ⅰ)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的△H<0,△S(熵变)<0,(填“>”、“<”或“=”).
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃;以CH3OH表示该过程的反应速率:v(CH3OH)=0.08mol/(L.min).
(2)图3表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(Ⅱ)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:
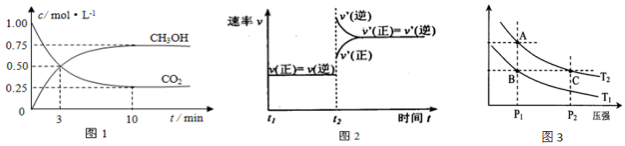
(1)从反应开始到10min达到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min).500℃达平衡时,CH3OH(g)的体积分数为30%.
(2)图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为放热反应(填“放热”或“吸热”).
(3)下列措施中不能使CO2的转化率增大的是BD.
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂.
(Ⅰ)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃;以CH3OH表示该过程的反应速率:v(CH3OH)=0.08mol/(L.min).
(2)图3表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(Ⅱ)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:

(1)从反应开始到10min达到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min).500℃达平衡时,CH3OH(g)的体积分数为30%.
(2)图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为放热反应(填“放热”或“吸热”).
(3)下列措施中不能使CO2的转化率增大的是BD.
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂.
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 室温下,1L pH=13的氢氧化钡溶液所含OH- 数为0.2NA | |
| B. | 标准状况下,0.1molAl3+含有的核外电子数为0.3 NA | |
| C. | 常温下,44gCO2中含有2NA个碳氧双键 | |
| D. | 将1 molN2 和3mol H2 通入密闭容器中,一定条件下充分反应,转移电子数为6NA |
1.实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

请回答下列问题:
(1)写出制备1,2二溴乙烷的反应原理方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2═CH2+Br2→BrCH2CH2Br.
(2)在此制备实验中,要尽可能迅速地把反应温度升高到170℃左右,最主要的目的是d(填序号).
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是判断装置是否堵塞.
(4)在装置C中应加入c(填序号),其目的是吸收反应中可能生成的酸性气体.
a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(5)判断该制备反应已经结束的最简单方法是D中溴水的颜色完全褪去.
(6)将1,2二溴乙烷粗产品置于分液漏斗中,加水振荡后静置,产物应在下(填“上”或“下”)层.
(7)若产物中有少量副产物乙醚,可用蒸馏的方法除去.

| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)写出制备1,2二溴乙烷的反应原理方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2═CH2+Br2→BrCH2CH2Br.
(2)在此制备实验中,要尽可能迅速地把反应温度升高到170℃左右,最主要的目的是d(填序号).
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是判断装置是否堵塞.
(4)在装置C中应加入c(填序号),其目的是吸收反应中可能生成的酸性气体.
a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(5)判断该制备反应已经结束的最简单方法是D中溴水的颜色完全褪去.
(6)将1,2二溴乙烷粗产品置于分液漏斗中,加水振荡后静置,产物应在下(填“上”或“下”)层.
(7)若产物中有少量副产物乙醚,可用蒸馏的方法除去.

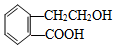 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.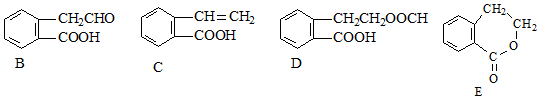
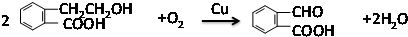 ,反应类型:氧化反应
,反应类型:氧化反应 ,反应类型:酯化反应
,反应类型:酯化反应 .
.