题目内容
6.从海带中提取碘的实验过程,正确的是( )
| A. | ①将海带灼烧成灰 | B. | ②过滤海带灰得到含I-的溶液 | ||
| C. | ③放出碘的苯溶液 | D. | ④分离碘并回收苯 |
分析 A.固体的灼烧应在坩埚中;
B.过滤应用玻璃棒引流;
C.苯的密度比水小,应从上口倒出;
D.碘易升华,蒸馏时,测定馏分的温度.
解答 解:A.不能在烧杯中高温灼烧固体,烧杯易炸裂,固体的灼烧应在坩埚中,故A错误;
B.过滤应用玻璃棒引流,防止浊液外漏,故B错误;
C.苯的密度比水小,从上口倒出,操作不合理,故C错误;
D.碘易升华,蒸馏时,冷凝管从下端进水,上端出水,温度计的水银球在支管口处,操作合理,故D正确;
故选D.
点评 本题考查化学实验操作,为高频考点,把握实验装置的作用、实验技能为解答的关键,意物质的分离方法取决于物质的性质,根据物质的性质的异同选取分离方法.题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
17.反应2A(g)+B(g)?2C(g)(吸热反应)下列反应条件有利于生成C的是( )
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
14.有一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料电池的说法不正确的是( )
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的总反应是 2C4H10+13O2=8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为 O2+4e-=2O2- | |
| D. | 通入丁烷的一极是负极,电极反应为 C4H10+13O2-+26e-=4CO2+5H2O |
1.下列有关物质应用的说法不正确的是( )
| A. | 氧化铁可用来制造红色油漆和涂料 | |
| B. | 生铁、普通钢和不锈钢中的含碳量依次减小 | |
| C. | 硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂 | |
| D. | 硅是生产光纤制品的基本原料 |
11.将BaO2放入密闭的真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡.保持温度不变,体积压缩为原来的一半,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | |
| B. | 平衡逆向移动,氧气的物质的量浓度减小 | |
| C. | 体系的压强不变 | |
| D. | BaO2的量增加 |
18.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1mol•L-1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)为( )
| A. | 0.15mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1? |
15.下列现象或变化过程与胶体的性质无关的是( )
| A. | 清晨森林中的道道光柱 | B. | 明矾净水 | ||
| C. | 海水的淡化 | D. | 河流入海处易形成沙洲 |
16.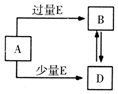 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )| A. | 若A是铁,则E可能为稀硝酸 | |
| B. | 若A是CuO,E是碳,则B为CO | |
| C. | 若A是NaOH溶液,E是CO2,则B为NaHCO3 | |
| D. | 若A是A1C13溶液,E可能是稀氨水 |