题目内容
7.常温下,下列有关离子浓度及pH大小的比较正确的是( )| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7 | |
| D. | pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7 |
分析 A.亚铁离子抑制铵根离子水解、碳酸根离子促进铵根离子水解,铵根离子水解程度越大,相同铵根离子浓度的溶液其浓度越大;
B.常温下,pH=3的醋酸浓度大于pH=11的NaOH,二者等体积混合,醋酸有剩余,溶液呈酸性,再结合电荷守恒判断;
C.pH=13的氢氧化钡溶液中c(OH-)等于pH=1的盐酸溶液中c(H+),二者的等体积混合后,二者恰好完全反应生成强酸强碱盐和水;
D.室温下,将pH=12 Ba(OH)2中氢氧根离子浓度为0.01mol/L,pH=14NaOH溶液中氢氧根离子浓度为1mol/L,两溶液混合后溶液中氢氧根离子浓度为:$\frac{0.01+1}{2}$mol/L=0.505mol/L>0.1mol/L.
解答 解:A.亚铁离子抑制铵根离子水解、碳酸根离子促进铵根离子水解,铵根离子水解程度越大,相同铵根离子浓度的溶液其浓度越大,所以NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为②>③>①,故A错误;
B.常温下,pH=3的醋酸浓度大于pH=11的NaOH,二者等体积混合,醋酸有剩余,溶液呈酸性,再结合电荷守恒得c(CH3COO-)>c(Na+),因为醋酸电离程度很小,所以溶液中存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.pH=13的氢氧化钡溶液中c(OH-)等于pH=1的盐酸溶液中c(H+),二者的等体积混合后,二者恰好完全反应生成强酸强碱盐和水,混合溶液呈中性,pH=7,故C错误;
D.室温下,将pH=12 Ba(OH)2中氢氧根离子浓度为0.01mol/L,pH=14NaOH溶液中氢氧根离子浓度为1mol/L,两溶液混合后溶液中氢氧根离子浓度为:$\frac{0.01+1}{2}$mol/L=0.505mol/L>0.1mol/L,则混合液的pH>13,所以混合液的pH范围为:13<pH<14,故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,涉及盐类水解、弱电解质的电离、酸碱混合溶液定性判断等知识点,侧重考查学生分析判断及计算能力,注意A中水解程度与盐浓度关系,为易错题.

| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
| A. | 0.15mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1? |
| A. | 清晨森林中的道道光柱 | B. | 明矾净水 | ||
| C. | 海水的淡化 | D. | 河流入海处易形成沙洲 |
| A. | 氧化产物和还原产物的物质的量之比为2:1 | |
| B. | 转移4 mol电子时,只需向装置中通人44.8 L H2(标准状况) | |
| C. | 装药品之前加热装置至100℃并持续一会儿 | |
| D. | 制备硼氢化钠的副产物可能有NaH |
| A. | 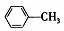 的一溴代物和 的一溴代物和 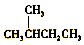 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | C5H11Cl有3种同分异构体 | |
| C. | 按系统命名法,化合物 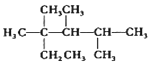 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一直线上 |
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④正反应速率一定大于逆反应速率
⑤反应物的浓度一定降低
⑥使用了合适的催化剂.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
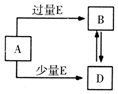 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )| A. | 若A是铁,则E可能为稀硝酸 | |
| B. | 若A是CuO,E是碳,则B为CO | |
| C. | 若A是NaOH溶液,E是CO2,则B为NaHCO3 | |
| D. | 若A是A1C13溶液,E可能是稀氨水 |
| A. | CH4 | B. | CH2═CH2 | C. | CO2 | D. | N2 |