题目内容
10. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na${\;}_{{2}_{\;}}$CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d(填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
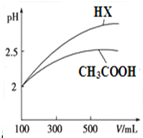
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(保留两位有效数字).
分析 (1)电离常数越大,酸性越强,其盐的水解程度越小,pH越小;
(2)CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,c(OH-)增大,Kw不变;
(3)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸;
(4)pH=6的溶液中氢离子浓度为10-6mol•L-1,根据混合液中的电荷守恒计算.
解答 解:(1)电离常数越大,酸性越强,其盐的水解程度越小,pH越小,所以溶液的pH由大到小排列的顺序是:a>c>b>d;
故答案为:a>c>b>d;
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,促进电离,c(H+)减小,c(OH-)增大,Kw不变,
A.由分析可知c(H+)减小,故A错误;
B.CH3COOH的物质的量减少,氢离子的物质的量增大,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故B正确;
C.c(H+)减小,c(OH-)增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$ 增大,故C正确;
D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=Ka,温度不变,Ka不变,故D错误;
故答案为:BC;
(3)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,所以HX的酸性大于醋酸,则HX的电离平衡常数大于醋酸,
故答案为:小于;
(4)pH=6的溶液中,氢离子浓度为10-6mol•L-1,氢氧根离子浓度为10-8mol•L-1,根据溶液呈存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可得:c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol•L-1-10-8mol•L-1=9.9×10-7mol•L-1,
故答案为:9.9×10-7.
点评 本题考查了弱电解质的电离,题目难度中等,明确弱电解质的电离特点、电离平衡常数与酸根离子水解程度的关系再结合守恒思想分析解答,试题培养了学生的灵活应用能力.

| A. | x<y | B. | x>y | C. | x﹦y | D. | 无法判断 |
| A. | 丙烯 | B. | 1-丁烯 | C. | 1-戊烯 | D. | 3-甲基-2-戊烯 |
| A. | 0.10 mol•L-1AgNO3 | B. | 0.20 mol•L-1Zn(NO3)2 | ||
| C. | 0.20 mol•L-1Cu(NO3)2 | D. | 0.20 mol•L-1Pb(NO3)2 |
| A. | 1mol O | B. | 1mol O2 | C. | 1mol氧原子 | D. | 1摩尔小麦 |
| A. | 元素原子第一电离能大小关系:Z>Y>W>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线形的共价化合物 | |
| C. | Y与M形成化合物键长大于Z与M形成化合物的键长 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
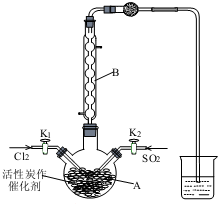 磺酰氯(SO2Cl2)用于有机合成、医药、染料、农药等,也用作表面活性剂,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解.某学习小组用如图装置制备磺酰氯.(已知:SO2(g)+Cl2(g)?SO2Cl2(l)△H<0).
磺酰氯(SO2Cl2)用于有机合成、医药、染料、农药等,也用作表面活性剂,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解.某学习小组用如图装置制备磺酰氯.(已知:SO2(g)+Cl2(g)?SO2Cl2(l)△H<0).