题目内容
8.写出分子式为C8H8O2,分子中有苯环且属于羧酸或酯的同分异构体的结构简式.分析 某有机物的分子式为C8H8O2,不饱和度为$\frac{2×8+2-8}{2}$=5,分子中含有苯环且属于羧酸或酯,含有1个侧链,侧链为-OOCCH3,或为-COOCH3,或为-CH2OOCH,或为-CH2COOH,含有2个侧链,侧链为-COOH、-CH3,或为-OOCH、-CH3,各有邻、间、对三种,据此解题.
解答 解:某有机物的分子式为C8H8O2,不饱和度为$\frac{2×8+2-8}{2}$=5,分子中含有苯环且属于羧酸或酯,可能含有酯基,可能含有羧基.
含有1个侧链,侧链为-OOCCH3,或为-COOCH3,或为-CH2OOCH,或为-CH2COOH,有4种:C6H5OOCCH3;C6H5COOCH3;C6H5CH2OOCH;C6H5CH2COOH;
含有2个侧链,侧链为-COOH、-CH3,或为-OOCH、-CH3,各有邻、间、对三种,有6种; ;
; ;
; ;
; ;
; ;
; ;
;
答:同分异构体的结构简式有:C6H5OOCCH3;C6H5COOCH3;C6H5CH2OOCH;C6H5CH2COOH; ;
; ;
; ;
; ;
; ;
; .
.
点评 本题考查有机化合物的异构现象,明确有机物的不饱和度是解本题关键,难度中等.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
18.下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
| A. | A | B. | B | C. | C | D. | D |
16.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 电解精炼铜时,阳极质量减少6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | NA个CH4在标准状况下的体积约为22.4L | |
| D. | 苯与液溴反应生成1mol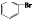 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
20.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2LHCl和11.2LNH3充分混合后含有的分子数为NA | |
| B. | 0.1mol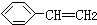 中含有碳碳双键的数目为0.4NA 中含有碳碳双键的数目为0.4NA | |
| C. | 常温常压下,1molNO2与水反应后,溶液中NO3-的数目为NA | |
| D. | 1molMg与足量空气反应生成MgO和Mg3N2,失去的电子数为2NA |
10. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na${\;}_{{2}_{\;}}$CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d(填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
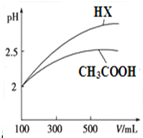
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(保留两位有效数字).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na${\;}_{{2}_{\;}}$CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d(填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(保留两位有效数字).
11.在某种接近中性的含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-6种离子中的几种.
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向呈橙黄色的溶液中滴加BaCl2时无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.则上述溶液中一定不存在的离子是( )
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向呈橙黄色的溶液中滴加BaCl2时无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.则上述溶液中一定不存在的离子是( )
| A. | NH4+、Br-、CO32- | B. | NH4+、I-、SO32- | C. | Fe2+、I-、SO32- | D. | Fe2+、Br-、CO32- |
 硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:


