题目内容
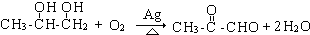
15.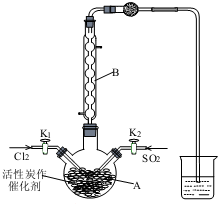 磺酰氯(SO2Cl2)用于有机合成、医药、染料、农药等,也用作表面活性剂,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解.某学习小组用如图装置制备磺酰氯.(已知:SO2(g)+Cl2(g)?SO2Cl2(l)△H<0).
磺酰氯(SO2Cl2)用于有机合成、医药、染料、农药等,也用作表面活性剂,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解.某学习小组用如图装置制备磺酰氯.(已知:SO2(g)+Cl2(g)?SO2Cl2(l)△H<0).(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)仪器B的作用是冷凝SO2Cl2(或使挥发的产物SO2Cl2冷凝).烧杯中盛放的溶液为NaOH.
(3)检验装置气密性的方法为关闭旋塞K1和K2,将导管出口置于水槽中,在三颈烧瓶底部加热,若导管口有气泡,移开酒精灯后能形成一段水柱,说明气密性良好.向装置A中通入SO2和Cl2 后很快有液态物质生成.制备过程中需采用冰水浴,从化学反应原理角度分析可能原因为生成SO2Cl2为放热反应,低温有利于反应向正反应方向进行.
(4)向分离提纯后的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.经分析SO2Cl2与H2O反应属于非氧化还原反应,无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,请设计方案检验溶液W中这两种阴离子取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42?,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl?.
分析 (1)浓盐酸与二氧化锰为原料制取Cl2,反应生成氯化镁、氯气和水;
(2)B为冷凝管,冷凝回流,烧杯中碱液可吸收尾气;
(3)利用微热法检验气密性;反应为放热反应,结合平衡移动分析;
(4)SO2Cl2与H2O反应属于非氧化还原反应,则生成硫酸根离子和氯离子,结合离子检验方法解答.
解答 解:(1)用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B为冷凝管,仪器B的作用是冷凝SO2Cl2(或使挥发的产物SO2Cl2冷凝).烧杯中盛放的溶液为NaOH,可吸收尾气,
故答案为:冷凝SO2Cl2(或使挥发的产物SO2Cl2冷凝); NaOH;
(3)检验装置气密性的方法为关闭旋塞K1和K2,将导管出口置于水槽中,在三颈烧瓶底部加热,若导管口有气泡,移开酒精灯后能形成一段水柱,说明气密性良好;
制备过程中需采用冰水浴,从化学反应原理角度可知生成SO2Cl2为放热反应,低温有利于反应向正反应方向进行,
故答案为:关闭旋塞K1和K2,将导管出口置于水槽中,在三颈烧瓶底部加热,若导管口有气泡,移开酒精灯后能形成一段水柱,说明气密性良好;生成SO2Cl2为放热反应,低温有利于反应向正反应方向进行;
(4)SO2Cl2与H2O反应属于非氧化还原反应,则生成硫酸根离子和氯离子,离子检验方法为取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42?,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl?,
故答案为:取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42?,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl?.
点评 本题考查制备实验及性质实验,为高频考点,把握物质的性质、发生的反应、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验操作及离子检验,题目难度中等.

 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na${\;}_{{2}_{\;}}$CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d(填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
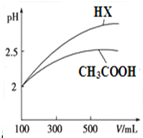
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(保留两位有效数字).
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | 水分子的比例模型: | ||
| C. | 硅的原子结构示意图: | D. | Na2S的电子式 |





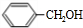 .
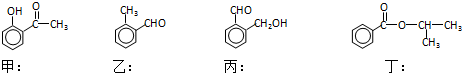
.
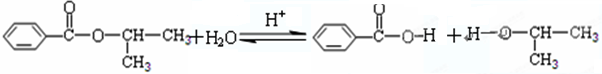 ;
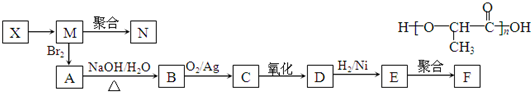
;
 .
. ;
; .
. (用电子式表示).
(用电子式表示).