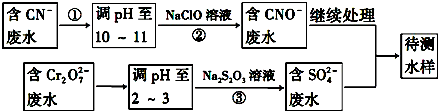
题目内容
5.下列烯烃中存在顺反异构体的是( )| A. | 丙烯 | B. | 1-丁烯 | C. | 1-戊烯 | D. | 3-甲基-2-戊烯 |
分析 存在顺反异构体的条件:分子中至少有一个键不能自由旋转(否则将变成另外一种分子),双键上同一碳上不能有相同的基团,根据存在顺反异构的条件对各选项中的有机物结构进行判断即可.
解答 解:A.丙烯为CH3CH=CH2,其中C=C连接相同的H原子,不具有顺反异构,故A错误;
B.1-丁烯为CH3CH2CH=CH2,其中C=C连接相同的H原子,不具有顺反异构,故B错误;
C.1-戊烯为CH2=CHCH2CH2CH3,其中C=C连接相同的H原子,不具有顺反异构,故C错误;
D.3-甲基-2-戊烯,其中C=C连接不相同的原子(团),具有顺反异构,故D正确;
故选D.
点评 本题考查顺反异构的判断,题目难度不大,注意掌握同分异构体的概念及类型,明确存在顺反异构体的条件为解题的关键,试题培养了学生的灵活应用能力.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
16.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 电解精炼铜时,阳极质量减少6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | NA个CH4在标准状况下的体积约为22.4L | |
| D. | 苯与液溴反应生成1mol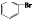 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
20.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2LHCl和11.2LNH3充分混合后含有的分子数为NA | |
| B. | 0.1mol 中含有碳碳双键的数目为0.4NA 中含有碳碳双键的数目为0.4NA | |
| C. | 常温常压下,1molNO2与水反应后,溶液中NO3-的数目为NA | |
| D. | 1molMg与足量空气反应生成MgO和Mg3N2,失去的电子数为2NA |
10. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na${\;}_{{2}_{\;}}$CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d(填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
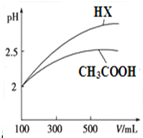
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(保留两位有效数字).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na${\;}_{{2}_{\;}}$CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d(填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(保留两位有效数字).
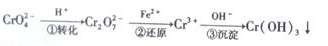
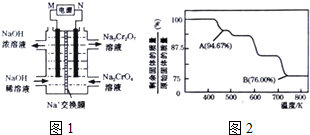





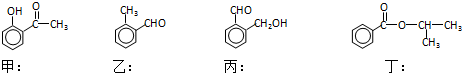
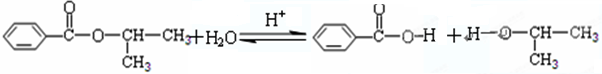 ;
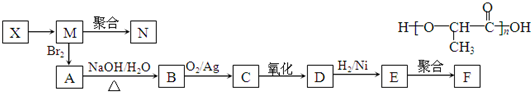
;
 .
. ;
; .
.