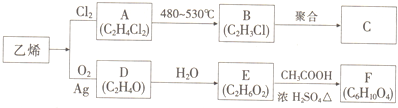
题目内容
5.电解100mL含c(H+)=0.30mol•L-1的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )| A. | 0.10 mol•L-1AgNO3 | B. | 0.20 mol•L-1Zn(NO3)2 | ||
| C. | 0.20 mol•L-1Cu(NO3)2 | D. | 0.20 mol•L-1Pb(NO3)2 |
分析 在金属活动性顺序表中,当金属位于H之前时,电解可溶性盐溶液,阴极上氢离子放电生成氢气;当金属位于H之后时,电解可溶性盐溶液,阴极上先金属阳离子放电后氢离子放电,据此分析解答.
解答 解:在金属活动性顺序表中,当金属位于H之前时,电解可溶性盐溶液,阴极上氢离子放电生成氢气;当金属位于H之后时,电解可溶性盐溶液,阴极上先金属阳离子放电后氢离子放电,
A.Ag位于H之后,所以电解硝酸银溶液中银离子先放电,n(Ag+)=0.10mol/L×0.1L=0.01mol,Ag离子完全反应消耗n(e-)=0.01mol<0.04mol,所以银离子完全放电生成0.01molAg,m(Ag)=0.01mol×108g/mol=1.08g;
B.Zn位于H之前,电解硝酸锌溶液时没有金属离子放电,所以没有金属析出;
C.Cu位于H之后,电解硝酸铜溶液时铜离子先放电,n(Cu 2+)=0.2mol/L×0.1L=0.02mol,铜离子完全放电转移电子物质的量=0.02mol×2=0.04mol,所以铜离子完全放电,m(Cu)=0.02mol×64g/mol=1.28g;
D.Pb位于H之前,电解硝酸铅溶液时氢离子放电,所以没有金属析出;
通过以上分析知,析出金属质量最大的是C,
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断及计算能力,明确离子放电顺序是解本题关键,注意BD没有金属析出,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.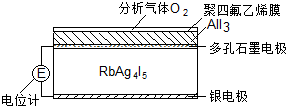 固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及
其它传感器、探测器等方面的应用日益广泛.如RbAg4I5晶体,其中迁移的离子全是Ag+,固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及
其它传感器、探测器等方面的应用日益广泛.如RbAg4I5晶体,其中迁移的离子全是Ag+,
室温导电率达0.27Ω-1•cm-1.利用RbAg4I5晶体,可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图.被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量.在气体传感器工作过程中,下列变化肯定没有发生的是( )
 固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及其它传感器、探测器等方面的应用日益广泛.如RbAg4I5晶体,其中迁移的离子全是Ag+,固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及
其它传感器、探测器等方面的应用日益广泛.如RbAg4I5晶体,其中迁移的离子全是Ag+,
室温导电率达0.27Ω-1•cm-1.利用RbAg4I5晶体,可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图.被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量.在气体传感器工作过程中,下列变化肯定没有发生的是( )
| A. | 4AlI3+3O2=2Al2O3+6I2 | B. | I2+2Ag++2e-=2AgI | ||
| C. | Ag-e-=Ag+ | D. | I2+2Rb++2e-=2RbI |
20.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2LHCl和11.2LNH3充分混合后含有的分子数为NA | |
| B. | 0.1mol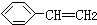 中含有碳碳双键的数目为0.4NA 中含有碳碳双键的数目为0.4NA | |
| C. | 常温常压下,1molNO2与水反应后,溶液中NO3-的数目为NA | |
| D. | 1molMg与足量空气反应生成MgO和Mg3N2,失去的电子数为2NA |
7.乙烷与乙炔相比较,下列叙述不正确的是( )
| A. | 都能燃烧,生成二氧化碳和水 | |
| B. | 乙炔易发生加成反应,乙烷不能发生加成反应 | |
| C. | 都能被高锰酸钾氧化,使酸性高锰酸钾溶液褪色 | |
| D. | 相同物质的量的乙烷和乙炔,完全燃烧时生成CO2量相同 |
10. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na${\;}_{{2}_{\;}}$CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d(填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
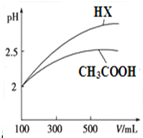
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(保留两位有效数字).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na${\;}_{{2}_{\;}}$CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d(填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(保留两位有效数字).
15.已知水的电离方程式:H2O?H++OH-.下列叙述中,正确的是( )
| A. | 升高温度,KW增大,pH变小 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸,c(H+)增大,KW变小 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |