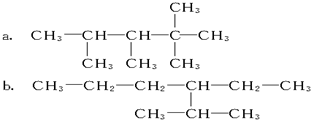
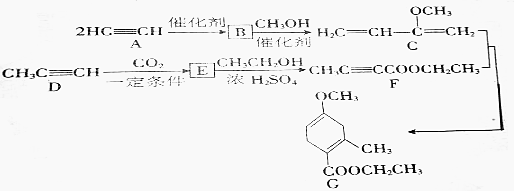
题目内容
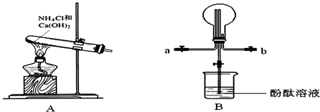
3.甲、乙、丙三位同学分别用图1所示实验装置制取氨气.请你根据实验探究的过程,回答下列有关问题.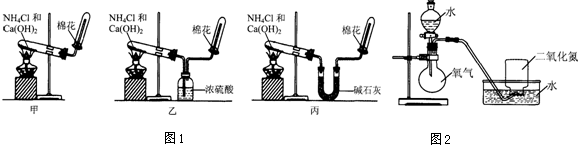
(1)三位同学制取氨气的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是乙(填图1中“甲”、“乙”或“丙”).
(3)为确定试管内是否已收集满氨气,应将湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒)置于收集气体的试管口处,若观察到试纸变蓝(或白烟产生),则说明氨气已收集满.
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的同学是丙(填图1中“甲”、“乙”或“丙”).
(5)氨气是一种重要的化工产品,氨气经一系列反应可制得硝酸,其中关键步骤之一是将二氧化氮溶于水生成硝酸.为使二氧化氮尽可能全部被水吸收,且残留的气体尽可能少,某同学设计了如图2所示的实验装置,进行了如下实验探究过程.请回答有关问题.
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为0.04mol/L. | |
分析 (1)依据图一装置可知三位同学制取氯气方法都是用加热固体 氯化铵和氢氧化钙的方法;
(2)浓硫酸为碱性气体,不能干燥氨气;
(3)氨气为碱性气体,能够使石蕊的红色石蕊试纸变蓝,氨气能够与氯化氢反应生成白色固体氯化铵,产生大量白烟,据此检验氨气存在;
(4)碳酸氢铵受热分解生成氨气、二氧化碳和水,制取纯净氨气应除去二氧化碳和水蒸气;
(5)二氧化氮溶于水,发生3NO2+H2O=2HNO3+NO,通入氧气发生2NO+O2=2NO2,重复操作②,总反应为4NO2+O2+2H2O=4HNO3,据此解答.
解答 解:(1)三位同学制取氯气方法都是用氯化铵和氢氧化钙加热生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)浓硫酸为碱性气体,能够与氨气反应吸收氨气,不能干燥氨气,所以乙同学不能收集到氨气;
故答案为:乙;
(3)氨气为碱性气体,能够使石蕊的红色石蕊试纸变蓝,氨气能够与氯化氢反应生成白色固体氯化铵,产生大量白烟,所以为确定试管内是否已收集满氨气,应将湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒)置于收集气体的试管口处,若观察到试纸变蓝(或白烟产生),则说明氨气已收集满;
故答案为;湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒);试纸变蓝(或白烟产生);
(4)碳酸氢铵受热分解生成氨气、二氧化碳和水,制取纯净氨气应除去二氧化碳和水蒸气,甲同学没有除去二氧化碳,乙同学用浓硫酸干燥氨气,能够吸收氨气,丙同学用碱石灰可以吸收氨气中的水蒸气和二氧化碳,能够制取氨气;
故选:丙;
(5)①依据方程式:3NO2+H2O=2HNO3+NO,可知3体积二氧化氮与水反应生成1体积一氧化氮,一氧化氮难溶于水,所以最终剩余气体约占集气瓶体积的三分之一;
②将水逐滴滴入烧瓶,向盛有NO2的集气瓶通入少量氧气后,停止通气,先后发生反应:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,所以看到的现象为:先由无色变为红棕色,再变成无色;
③多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,最终二氧化氮全部被吸收生成硝酸,所以气体不再变成红棕色;
依据4NO2+O2+2H2O=4HNO3,可知二氧化氮都能转化为硝酸,448mLNO2全部溶于水,得到500mL溶液,则硝酸的物质的量=$\frac{0.448L}{22.4L/mol}$=0.02mol;
硝酸的物质的量浓度C=$\frac{0.02mol}{0.5L}$=0.04mol/L;
故答案为:
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的 三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是 先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成 红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为 0.04mol/L. | |
点评 本题以氨气、硝酸的制备为载体,考查了氨气制备方法、硝酸的制备方法,明确制备原理及氨气、一氧化氮、二氧化氮的性质是解题关键,题目难度中等.

 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )| A. | X原子可能为第VA族元素 | |
| B. | 该分子中既含有极性共价键又含有非极性共价键 | |
| C. | Y 原子可能为第ⅠA 族或第ⅦA 族元素元素 | |
| D. | 从圆球的大小分析,该分子可能为 N2F4 |
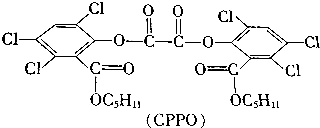
如果苯环上取代基位置和官能团位置都不改变,CPPO的结构有( )
| A. | 32种 | B. | 36种 | C. | 64种 | D. | 72种 |
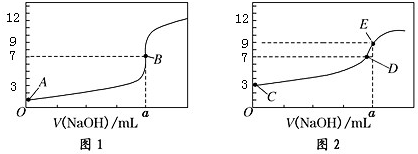
以下说法正确的是( )
| A. | 图 1 是滴定 CH3COOH 溶液的曲线 | |
| B. | 图 2 若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点 D 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果 C、E 两点对应的 pH 分别为 3、9,则水电离的氢离子浓度之比为 1:100 |
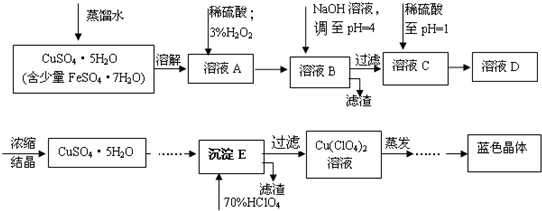
已知:
| 离子 | 溶液pH值 | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 5.2 | 6.4 |
(2)溶液C中加入稀硫酸调至pH=1的目的是防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体.
(3)如欲检验溶液C中的杂质是否除净,其操作是取少量溶液,加入KSCN溶液(NH4SCN溶液),观察溶液是否仍然为蓝色.
(4)蒸发至有晶膜出现(填写现象),然后经过冷却结晶、过滤、洗涤、低温烘干(或自然干燥)(填写操作),得到纯净的蓝色晶体.
(5)为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、加水溶解、加入过量NaOH溶液、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.6348g.
(6)该样品的纯度为91.9%.如果样品的实际纯度为93.2%,则测定的相对误差为-1.4%.

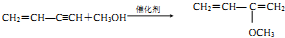 .
.