题目内容
13.有机化合物G是合成某种酯的中间体,可由下列路线合成(部分反应条件略去):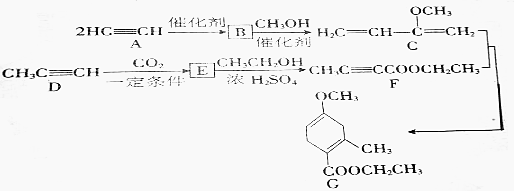
回答下列问题.
(1)A→B为加成反应,则B的结构简式是CH2=CHC≡CH,B与等物质的量的HCl加成可得氯丁橡胶的单体2-氯丁二烯,其结构简式为CH2=CHCCl=CH2.
(2)B→C的反应类型也是加成反应,该反应的化学方程式为
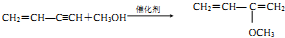 .
.(3)E的结构简式为CH3C≡CCOOH,D→E的反应类型为加成反应.
(4)E→F的化学方程式为CH3C≡CCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3C≡CCOOCH2CH3+H2O,其反应类型为酯化反应.
(5)G中含有的官能团名称是酯基、碳碳双键、醚键,其分子式为C11H16O3.
分析 从流程图可以看出,A→B为加成反应,结合C的结构可知,B为CH2=CHC≡CH,对比B、C的结构可知,由F的结构逆推可知E为CH3C≡CCOOH,对比D、E的结构可知,二氧化碳中碳氧双键断裂,与丙炔发生加成反应生成E,E与乙醇发生酯化反应得到F(CH3C≡CCOOCH2CH3),C与F发生加成反应生成G,据此答题;
解答 解:从流程图可以看出,A→B为加成反应,结合C的结构可知,B为CH2=CHC≡CH,对比B、C的结构可知,由F的结构逆推可知E为CH3C≡CCOOH,对比D、E的结构可知,二氧化碳中碳氧双键断裂,与丙炔发生加成反应生成E,E与乙醇发生酯化反应得到F(CH3C≡CCOOCH2CH3),C与F发生加成反应生成G,
(1)根据上面的分析可知,B为为CH2=CHC≡CH,B与等物质的量的HCl加成可得氯丁橡胶的单体2-氯丁二烯,其结构简式为CH2=CHCCl=CH2,
故答案为:CH2=CHC≡CH;CH2=CHCCl=CH2;
(2)B生成C的化学方程式为: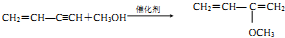 ,
,
故答案为: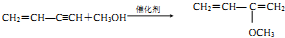 ;
;
(3)根据上面的分析可知,E为CH3C≡CCOOH,D→E的反应类型为加成反应,
故答案为:CH3C≡CCOOH;加成反应;
(4)E→F的反应是E(CH3C≡CCOOH)和CH3CH2OH发生的酯化反应,所以反应方程式为CH3C≡CCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3C≡CCOOCH2CH3+H2O,其反应类型为酯化反应,
故答案为:CH3C≡CCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3C≡CCOOCH2CH3+H2O;酯化反应;
(5)根据G的结构简式可知,G中含有的官能团名称是酯基、碳碳双键、醚键,其分子式为C11H16O3,
故答案为:酯基、碳碳双键、醚键;C11H16O3.
点评 本题考查有机物推断与合成、限制条件同分异构体书写、有机物结构与性质等,根据已知物质结构、反应条件进行推断,注意根据结构简式理解化学键的断裂与形成,侧重考查分析推断能力,难度中等.

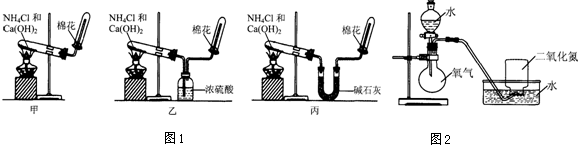
(1)三位同学制取氨气的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是乙(填图1中“甲”、“乙”或“丙”).
(3)为确定试管内是否已收集满氨气,应将湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒)置于收集气体的试管口处,若观察到试纸变蓝(或白烟产生),则说明氨气已收集满.
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的同学是丙(填图1中“甲”、“乙”或“丙”).
(5)氨气是一种重要的化工产品,氨气经一系列反应可制得硝酸,其中关键步骤之一是将二氧化氮溶于水生成硝酸.为使二氧化氮尽可能全部被水吸收,且残留的气体尽可能少,某同学设计了如图2所示的实验装置,进行了如下实验探究过程.请回答有关问题.
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为0.04mol/L. | |
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 蒸馏、分液、萃取 | D. | 蒸馏、萃取、分液 |
| A. | 由非金属元素组成的化合物不一定都是共价化合物 | |
| B. | 共价化合物中一定含有极性键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 所有气体单质分子中一定含有非极性键 |
| A组 | B组 | C组 | D组 |
| 金刚石:3110℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-114℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
(1)A组属于原子晶体,其熔化时克服的微粒间的作用力是共价键;
(2)B组晶体共同的物理性质是①②③(填序号);
①有金属光泽 ②导电性 ③延展性
(3)C组中HF熔点反常是由于HF分子之间存在氢键;
(4)D组晶体可能具有的性质是①②(填序号);
①水溶液能导电 ②熔融状态能导电 ③固体能导电.
| A. | 氯化镁的电子式: | B. | 乙醇的分子式是C2H6O | ||
| C. | 乙烯的结构简式为CH2CH2 | D. | 钾的原子结构示意图 |
| A. | 能使甲基橙试液显红色的溶液中:Na+、NH4+、I-、NO3- | |
| B. | 能使苯酚变紫色的溶液:K+、Mg2+、I-、SO42- | |
| C. | 由水电离出来的c(H+)=1×10-13 mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{K_w}{{c({H^+})}}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: