题目内容
7. 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )| A. | X原子可能为第VA族元素 | |
| B. | 该分子中既含有极性共价键又含有非极性共价键 | |
| C. | Y 原子可能为第ⅠA 族或第ⅦA 族元素元素 | |
| D. | 从圆球的大小分析,该分子可能为 N2F4 |
分析 根据球棍模型可知X能形成3个共价键,则X最外层含有5个电子,Y形成1个共价键,且最外层达到8电子稳定结构,则Y原子最外层含有7个电子,据此分析.
解答 解:由球棍模型可知X能形成3个共价键,则X最外层含有5个电子,Y形成1个共价键,且最外层达到8电子稳定结构,则Y原子最外层含有7个电子,
A、由球棍模型可知X能形成3个共价键,则X最外层含有5个电子,则X原子可能为ⅤA族元素,故A正确;
B、该分子中,X-Y键为极性键,X-X键为非极性键,故B正确;
C、Y形成1个共价键,且最外层达到8电子稳定结构,则Y原子最外层含有7个电子,则Y原子只能为VIIA族元素,故C错误;
D、F原子的半径小于N原子,则从圆球的大小分析,该分子可能为N2F4,故D正确.
故选:C.
点评 本题考查了球棍模型的分析判断,判断化合物的化学式进而判断XY原子在周期表中的位置是解答的关键,难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
18.下列能级符号表示错误的是( )
| A. | 2p | B. | 4d | C. | 5s | D. | 3f |
15.已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
物质A由a、e 构成,B、C、D、K都是单质,反应①--⑤都是用于工业生产的反应,
各有关物质之间的相互反应转化关系如图所示:
请填写下列空白:
(1)写出下列B的化学式Cl2,F的电子式 .;
.;
(2)写出反应H+E(溶液)→M的离子方程式:H++ClO-═HClO;
(3)用单线桥表示I与K反应的电子转移方向和数目: .
.
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 二核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
各有关物质之间的相互反应转化关系如图所示:

请填写下列空白:
(1)写出下列B的化学式Cl2,F的电子式
 .;
.;(2)写出反应H+E(溶液)→M的离子方程式:H++ClO-═HClO;
(3)用单线桥表示I与K反应的电子转移方向和数目:
 .
.
16.化合物 含有的官能团有( )
含有的官能团有( )
 含有的官能团有( )
含有的官能团有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
3.甲、乙、丙三位同学分别用图1所示实验装置制取氨气.请你根据实验探究的过程,回答下列有关问题.
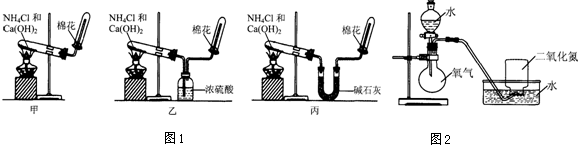
(1)三位同学制取氨气的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是乙(填图1中“甲”、“乙”或“丙”).
(3)为确定试管内是否已收集满氨气,应将湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒)置于收集气体的试管口处,若观察到试纸变蓝(或白烟产生),则说明氨气已收集满.
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的同学是丙(填图1中“甲”、“乙”或“丙”).
(5)氨气是一种重要的化工产品,氨气经一系列反应可制得硝酸,其中关键步骤之一是将二氧化氮溶于水生成硝酸.为使二氧化氮尽可能全部被水吸收,且残留的气体尽可能少,某同学设计了如图2所示的实验装置,进行了如下实验探究过程.请回答有关问题.

(1)三位同学制取氨气的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是乙(填图1中“甲”、“乙”或“丙”).
(3)为确定试管内是否已收集满氨气,应将湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒)置于收集气体的试管口处,若观察到试纸变蓝(或白烟产生),则说明氨气已收集满.
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的同学是丙(填图1中“甲”、“乙”或“丙”).
(5)氨气是一种重要的化工产品,氨气经一系列反应可制得硝酸,其中关键步骤之一是将二氧化氮溶于水生成硝酸.为使二氧化氮尽可能全部被水吸收,且残留的气体尽可能少,某同学设计了如图2所示的实验装置,进行了如下实验探究过程.请回答有关问题.
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为0.04mol/L. | |
 ;
; ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
.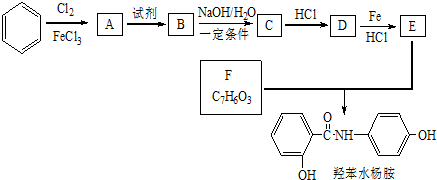
 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
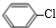 +HNO3$→_{△}^{浓H_{2}SO_{4}}$
+HNO3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.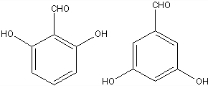 、
、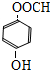 .
.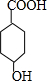 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$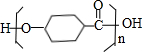 +(n-1)H2O.
+(n-1)H2O.