题目内容
12.酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,碘酸钾也能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下:
(1)配平步骤①反应器发生的反应,并标出电子转移的方向和总数:
6I2+11KClO3+3H2O→6KH(IO3)2+5KCl+3Cl2
(2)步骤②中,用硝酸而不用HI,其原因可能是HI具有还原性能将已生成的碘酸氢钾还原;
(3)步骤②要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为反应产生氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到KIO3;
(4)从步骤9到步骤10得到碘酸钾晶体,操作顺序是A、B、D .
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤.
分析 工业生产碘酸钾的流程:用碘和氯酸钾溶液反应生成碘酸氢钾、氯化钾和氯气,再加入硝酸,加热促使氯气从反应体系中逸出,经冷却结晶,过滤得碘酸氢钾晶体,将碘酸氢钾晶体溶于水,加入氢氧化钾溶液,使碘酸氢钾生成碘酸钾,过滤后得碘酸钾溶液,将滤液进行蒸发浓缩、冷却结晶、过滤洗涤,可得碘酸钾晶体,
(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数;
(2)酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性,但是硝酸不具备;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾;
(4)从溶液中获得晶体一般的步骤为蒸发浓缩、冷却结晶、过滤洗涤、干燥.
解答 解:工业生产碘酸钾的流程:用碘和氯酸钾溶液反应生成碘酸氢钾、氯化钾和氯气,再加入硝酸,加热促使氯气从反应体系中逸出,经冷却结晶,过滤得碘酸氢钾晶体,将碘酸氢钾晶体溶于水,加入氢氧化钾溶液,使碘酸氢钾生成碘酸钾,过滤后得碘酸钾溶液,将滤液进行蒸发浓缩、冷却结晶、过滤洗涤,可得碘酸钾晶体,
(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,电子转移方向和数目为 ,
,
故答案为:6,11,3,6; ;
;
(2)步骤中产生氯气,需要将氯气排出反应体系,加入硝酸的目的是制造酸性环境,促进氯气从反应体系中逸出,酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性,能将已生成的碘酸氢钾还原,
故答案为:HI具有还原性能将已生成的碘酸氢钾还原;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾,所以应将氯气排出,
故答案为:反应产生氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到KIO3;
(4)从溶液中获得晶体一般的步骤为蒸发浓缩、冷却结晶、过滤洗涤、干燥,故操作顺序是A、B、D,
故答案为:A、B、D.
点评 本题以工业生产碘酸钾为载体,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,内容涉及方程式配平、对工艺流程的理解评价、方案设计等,难度中等,是对知识的综合运用和能力的考查.

 阅读快车系列答案
阅读快车系列答案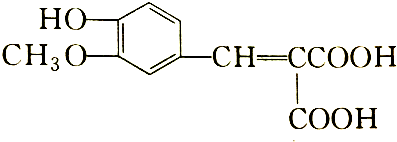 含有的官能团有( )
含有的官能团有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
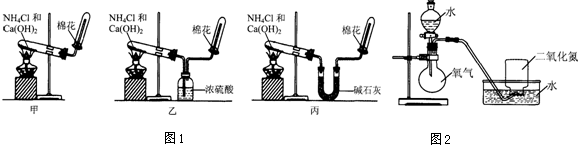
(1)三位同学制取氨气的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是乙(填图1中“甲”、“乙”或“丙”).
(3)为确定试管内是否已收集满氨气,应将湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒)置于收集气体的试管口处,若观察到试纸变蓝(或白烟产生),则说明氨气已收集满.
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的同学是丙(填图1中“甲”、“乙”或“丙”).
(5)氨气是一种重要的化工产品,氨气经一系列反应可制得硝酸,其中关键步骤之一是将二氧化氮溶于水生成硝酸.为使二氧化氮尽可能全部被水吸收,且残留的气体尽可能少,某同学设计了如图2所示的实验装置,进行了如下实验探究过程.请回答有关问题.
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为0.04mol/L. | |
(1)这六种元素中除H、C、O、P、S外,应该还有N(写元素符号),它的原子最外层共有5种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置第二周期IVA族.CO2是一种温室气体,它的电子式为
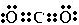 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.(2)糖类是人体获得能量的来源之一.已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804kJ的热量,该反应的热化学方程式C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)△H=-2804kJ•mol-1.
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是D(填序号).
A、离子半径:S2->Na+>O2->H+ B、与水反应的剧烈程度:K>Na>Mg>Ca
C、熔点:CO2>SiO2>Na2O>SO3 D、还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
| A. | 83 | B. | 81 | C. | 85 | D. | 56 |
| A. | C3H8中碳原子都采用的是sp3杂化 | |
| B. | O2、CO2、N2都是非极性分子 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO | |
| D. | CO的一种等电子体为NO+,它的电子式为+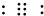 |
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 蒸馏、分液、萃取 | D. | 蒸馏、萃取、分液 |
| A. | 由非金属元素组成的化合物不一定都是共价化合物 | |
| B. | 共价化合物中一定含有极性键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 所有气体单质分子中一定含有非极性键 |
 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: