题目内容
 (1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为
(1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为(2)在25℃时,有pH=m(m≤6)的盐酸VmL和pH=n (n8)的NaOH溶液VnL.二者混合恰好完全中和.问:若n+m=13时,则Vm/Vn=
(3)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应置于
考点:化学平衡的计算,原电池和电解池的工作原理
专题:
分析:(1)反应物和产物都是气体,混合气体的总质量不变,由ρ=
可知,密度与气体的体积成反比,根据三段式列式计算出;
(2)在25℃时,有pH=m(m≤6)的盐酸VmL和pH=n (n8)的NaOH溶液VnL,二者混合恰好完全中和,则有VmL×10-mmol/L=VnL×10n-14mol/L,整理可得:Vm:Vn=10m+n-14,以此解答;
(3)作原电池正极或作电解池阴极的金属被保护.
| m |
| v |
(2)在25℃时,有pH=m(m≤6)的盐酸VmL和pH=n (n8)的NaOH溶液VnL,二者混合恰好完全中和,则有VmL×10-mmol/L=VnL×10n-14mol/L,整理可得:Vm:Vn=10m+n-14,以此解答;
(3)作原电池正极或作电解池阴极的金属被保护.
解答:
解:(1)设SO2的转化率为x,
对于反应:2SO2(g)+O2(g)?2SO3(g)
开始(L):1 3 0
变化(L):x 0.5x x
平衡(L) 1-x 3-0.5x x
同温同压下,气体的密度与物质的量成反比,
根据密度之比列式为(1-x+3-0.5x+x):(1+3)=0.9:1,
解得x=0.8,
则SO2平衡转化率为
×100%=80%,
(2)在25℃时,有pH=m(m≤6)的盐酸VmL和pH=n (n8)的NaOH溶液VnL,二者混合恰好完全中和,则有VmL×10-mmol/L=VnL×10n-14mol/L,整理可得:Vm:Vn=10m+n-14,若m+n=13,则:m+n-14=-1,所以Vm/Vn=10m+n-14=0.1=1/10,故答案为:1/10;
(3)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法.
对于反应:2SO2(g)+O2(g)?2SO3(g)
开始(L):1 3 0
变化(L):x 0.5x x
平衡(L) 1-x 3-0.5x x
同温同压下,气体的密度与物质的量成反比,
根据密度之比列式为(1-x+3-0.5x+x):(1+3)=0.9:1,
解得x=0.8,
则SO2平衡转化率为
| 1×0.8 |
| 1 |
(2)在25℃时,有pH=m(m≤6)的盐酸VmL和pH=n (n8)的NaOH溶液VnL,二者混合恰好完全中和,则有VmL×10-mmol/L=VnL×10n-14mol/L,整理可得:Vm:Vn=10m+n-14,若m+n=13,则:m+n-14=-1,所以Vm/Vn=10m+n-14=0.1=1/10,故答案为:1/10;
(3)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法.
点评:本题考查化学平衡转化率的计算、酸碱中和的计算、金属的腐蚀与防护等,题目难度中等,明确酸碱中和时氢离子与氢氧根离子的物质的关系、注意掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
相关题目
下列溶液中,一定能大量共存的微粒组是( )
| A、室温下,pH=1的溶液中:Na+、Fe2+、NO-3、SO42- |
| B、由水电离的c(H+)=1×10-13 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
| D、c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
将一定量的NaHCO3和NH4HCO3的混合物放入坩埚内,用酒精加热到质量不变时,最终称得残留物得质量是原来的一半,则原混合物中NH4HCO3的质量数为 ( )
| A、25% |
| B、20.75% |
| C、17.85% |
| D、26.45% |
工业上由重晶石制取可溶性钡盐,对已经粉碎后的矿石首先进行的处理方法应是( )
| A、水溶法 | B、酸溶法 |
| C、碱溶法 | D、还原法 |
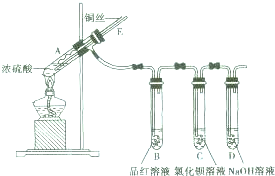 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.实验步骤:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.实验步骤: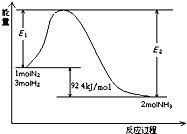



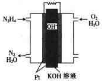 燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:
燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题: