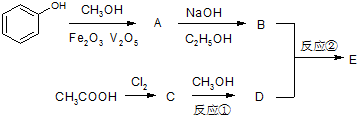题目内容
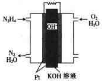 燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:
燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:(1)该燃料电池中,负极通入的气体是
(2)电池工作时,OH-向
(3)肼在工业上常以氨和次氯酸钠为原料制得,其反应的化学方程式为2NH3+NaClO═N2H4+NaCl+H2O,若将氨气和次氯酸钠的反应设计成原电池,则该原电池正极的电极反应式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)在肼(N2H4)燃料电池中,通入燃料气体N2H4为负极,通入O2的一极为正极;
(2)在原电池中,阴离子向负极移动,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O;
(3)根据化学方程式为2NH3+NaClO═N2H4+NaCl+H2O,NaClO在正极放电,得电子发生还原反应.
(2)在原电池中,阴离子向负极移动,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O;
(3)根据化学方程式为2NH3+NaClO═N2H4+NaCl+H2O,NaClO在正极放电,得电子发生还原反应.
解答:
解:(1)在肼(N2H4)燃料电池中,通入燃料气体N2H4为负极,通入O2的一极为正极;故答案为:N2H4;O2;
(2)在原电池中,阴离子向负极移动,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:负;N2H4-4e-+4OH-=N2+4H2O;
(3)将氨气和次氯酸钠的反应设计成原电池,根据化学方程式为2NH3+NaClO═N2H4+NaCl+H2O,NaClO在正极放电,得电子发生还原反应,电极反应式为为ClO-+2e-+H2O=Cl-+2OH-,故答案为:ClO-+2e-+H2O=Cl-+2OH-.
(2)在原电池中,阴离子向负极移动,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:负;N2H4-4e-+4OH-=N2+4H2O;
(3)将氨气和次氯酸钠的反应设计成原电池,根据化学方程式为2NH3+NaClO═N2H4+NaCl+H2O,NaClO在正极放电,得电子发生还原反应,电极反应式为为ClO-+2e-+H2O=Cl-+2OH-,故答案为:ClO-+2e-+H2O=Cl-+2OH-.
点评:本题考查燃料电池,根据原电池原理来分析解答即可,注意电极反应式的书写要结合溶液的酸碱性,为易错点.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,以下各物质所含分子数最少的是( )
| A、含2NA个氢分子的氢气 |
| B、17g氨气(NH3的摩尔质量为17g?mol-l) |
| C、0.8mol氧气 |
| D、标准状况下11.2 L氯气 |
由于Fe(OH)2极易被氧化,所以实验室里很难用亚铁盐溶液与烧碱反应制的白色纯净的Fe(OH)2沉淀.应用如图所示的电解实验可制得白色纯净Fe(OH)2沉淀,两电极的材料分别为石墨和铁.下列说法正确的是( )
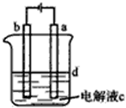

| A、a电极发生的电极反应:4OH--4e-=O2↑+2H2O |
| B、为了在较短时间内看到白色沉淀,可适当加大电压 |
| C、c可以是氯化钠溶液,d可以是苯 |
| D、为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
 (1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为
(1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为
 (R,R′为烃基,可以相同,也可以不同)有机物E是重要的有机合成中间体,其合成工艺流程如图:
(R,R′为烃基,可以相同,也可以不同)有机物E是重要的有机合成中间体,其合成工艺流程如图: