题目内容
3.铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途.请回答以下问题:
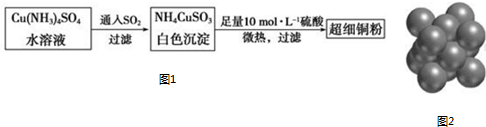
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如图1:
①Cu2+的价电子排布图
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).②SO42-的空间构型为正四面体形,SO32-离子中心原子的杂化方式为sp3杂化.
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式.2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出SO4•H2O晶体.
①下列说法正确的是c
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因.乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度
(4)Cu晶体的堆积方式如图2所示,设Cu原子半径为r,晶体中Cu原子的配位数为,晶体的空间利用率为$\frac{4×\frac{4}{3}π{r}^{3}}{{a}^{3}}$=$\frac{4×\frac{4}{3}π{r}^{3}}{(2\sqrt{2}r)^{3}}$×100%=74.76%(列式).
分析 (1)①Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为 ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小;
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小;
②SO42-的价层电子对数=4+$\frac{1}{2}$(6+2-4×2)=4,所以空间构型为正四面体型;SO32-离子的价层电子对数=3+$\frac{1}{2}$(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;
(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式;
(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键;
d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素;
②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长a=2$\sqrt{2}$r,1个Cu的体积是4/3πr3,晶胞中Cu原子的个数是4个,所以晶体的空间利用率为$\frac{4×\frac{4}{3}×π{r}^{3}}{{a}^{3}}$.
解答 解:(1)①Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为 ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;
故答案为: ;N>O>S;
;N>O>S;
②SO42-的价层电子对数=4+$\frac{1}{2}$(6+2-4×2)=4,所以空间构型为正四面体型;SO32-离子的价层电子对数=3+$\frac{1}{2}$(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;
故答案为:正四面体形;sp3杂化;
(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
故答案为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,故a错误;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,故b 错误;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,故c正确;
d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素,故d错误,
故答案为:c;
②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
故答案为:乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长a=2$\sqrt{2}$r,1个Cu的体积是$\frac{4}{3}$πr3,晶胞中Cu原子的个数是4个,所以晶体的空间利用率为$\frac{4×\frac{4}{3}π{r}^{3}}{{a}^{3}}$=$\frac{4×\frac{4}{3}π{r}^{3}}{(2\sqrt{2}r)^{3}}$×100%=74.76%.
故答案为:12;$\frac{4×\frac{4}{3}π{r}^{3}}{{a}^{3}}$=$\frac{4×\frac{4}{3}π{r}^{3}}{(2\sqrt{2}r)^{3}}$×100%=74.76%.
点评 本题考查了物质制备实验方案,物质结构的计算分析,浸提结构的堆积方式和利用率的计算应用,掌握基础是关键,题目难度中等.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
回答下列问题:
(1)合成氨所需的氮气来源于空气;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
(2)在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;
上述流程中热交换器的作用是热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气.从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨.为提高原料的利用率,通常采取的措施是将N2,H2循环利用.
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快.②该温度下催化剂的活性较大.
(4)氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):2NH3+CO2$\stackrel{加热加压}{→}$H2NCOONH4.
②氨基甲酸铵受热分解为尿素与水:H2NCOONH4$\stackrel{△}{→}$CO(NH2)2+H2O.
(5)新法合成氨常采用电解法合成.即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率.新法合成氨所用的电解质能传导H+,则阴极的电极反应式为N2+6H++6e-═2NH3.
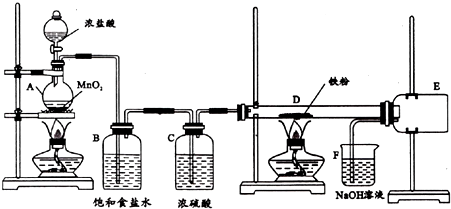
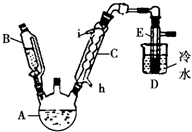 如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.
如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.| 乙醇 | 溴乙烷 | 溴 | |
| 通常情况下状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)冷却剂应从h(填“h”或“i”)口进入冷凝管C中,制备操作中,加入的浓硫酸必须进行适当稀释,其目的(或原因)是b(填字母).
a.水是反应的催化剂 b.减少Br2的生成 c.减少HBr的挥发
(3)加热的目的是加快反应速率且使溴乙烷汽化,使用D进行冷却的原因是使溴乙烷液化便于收集.
(4)A中液面上有深红棕色气体出现,写出生成它的化学方程式2HBr+H2SO4(浓)$\stackrel{△}{→}$Br2↑+2H2O+SO2↑,写出A中生成溴乙烷的化学方程式HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O.
(5)将E中产品转入到分液漏斗中,再向漏斗中加入适量Na2SO3溶液,振荡静置后分液.加入Na2SO3溶液的目的是除去单质溴等杂质,分液时目标产物离开漏斗的方式是从下面的导管排出来.
已知:2Na2CO3+3H2O2=2Na2CO3•3H2O2△H<0;回答下列问题:
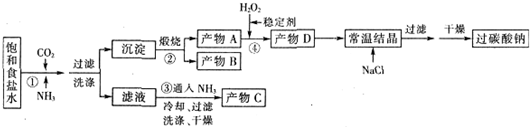
(1)下列物质可使过碳酸钠较快失效的是(填序号)ABC.
A.FeCl3溶液 B.H2S C.稀硫酸 D.NaHCO3溶液
(2)反应①应先通入的气体是氨气.写出反应①的化学方程式NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓(写总反应)
(3)加入NaCl的作用是降低2Na2CO3•3H2O2的溶解度,析出更多晶体.
(4)该生产流程中可循环使用的物质是CO2(填化学式).
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,该步操作名称是晶体的洗涤;进行该操作的方法是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次.
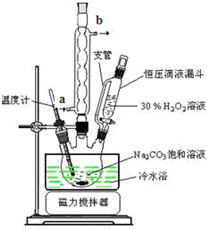
(6)实验室利用图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是使液体顺利流下,冷凝管应从a处进水.
(7)由实验测定反应温度对产物的影响如表:根据表数据,你认为反应最佳的温度选择的范围是15~20℃.
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |