题目内容
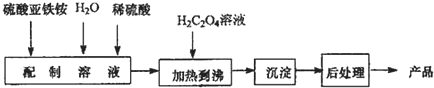
12.以工业废铁屑(含有一些不溶于酸的杂质)为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,其主要流程如图:
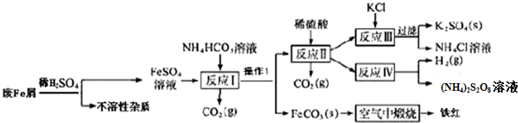
(1)反应I加入NH4HCO3的作用是除去过量的酸,还有一个作用是沉淀Fe2+;
(2)操作①名称是过滤,检验反应Ⅱ溶液中阳离子的方法是取少许溶液于试管中,加入浓氢氧化钠溶液加热,用湿润的红色石蕊试纸检验,试纸变蓝色证明生成了氨气,原溶液中含铵根离子;
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是降低K2SO4的溶解度,有利于K2SO4析出;
(4)己知FeCO3的Ksp=2×10-11,反应I中Fe2+完全沉淀后,溶液中c(CO32-)=2×10-6mol/L;
(5)写出FeCO3在空气中锻烧的化学反应方程式4FeCO3 +O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3 +4CO2;
(6)NH4Cl溶液显酸性,其浓溶液可用于除去铁锈,其原理是(用离子反应方程式表示)NH4++H2O?NH4•H2O+H+、Fe2O3+6H+=2Fe3++3H2O.
分析 废铁屑加入稀硫酸溶解过滤得到硫酸亚铁溶液和不溶性杂质,FeSO4溶液中加入碳酸氢铵经反应Ⅰ可生成碳酸亚铁固体和硫酸铵溶液,碳酸亚铁固体经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成铁红.反应Ⅰ过滤后的溶液中含有硫酸铵、未反应的碳酸氢铵,加入硫酸反应后溶液中含有硫酸铵,反应Ⅲ加入KCl利用溶解度不同,得到硫酸钾与氯化铵,再进行过滤分离,反应Ⅳ在电解条件得到(NH4)2S2O8与氢气,
(1)FeSO4溶液中加入碳酸氢铵经反应Ⅰ可生成碳酸亚铁固体和硫酸铵溶液;
(2)分析可知操作①是分离固体和溶液的操作;反应Ⅱ溶液中阳离子为铵根离子,检验铵根离子失利用铵根离子和碱反应生成的氨气能使湿润的红色石蕊试纸变蓝设计检验;
(3)K2SO4易溶于水,但难溶于有机溶剂,要想使K2SO4析出需加入醇类溶剂,降低其溶解度;
(4)FeCO3的Ksp=2×10-11,反应I中Fe2+完全沉淀后溶液中亚铁离子浓度小于10-5mol/L,据此计算;
(5)空气中煅烧FeCO3生成铁红,碳酸亚铁和氧气反应生成氧化铁和二氧化碳;
(6)NH4Cl溶液因为水解原因呈酸性,氧化铁溶于酸生成铁离子和水.
解答 解:(1)FeSO4溶液中加入碳酸氢铵经反应Ⅰ可生成碳酸亚铁固体和硫酸铵溶液,同时生成二氧化碳气体,加入NH4HCO3的作用是除去过量的酸,还有一个作用是沉淀亚铁离子,故答案为:沉淀Fe2+;
(2)操作①是分离固体和溶液的操作;反应Ⅱ溶液中阳离子为铵根离子,检验铵根离子失利用铵根离子和碱反应生成的氨气能使湿润的红色石蕊试纸变蓝设计,取少许溶液于试管中,加入浓氢氧化钠溶液加热,用湿润的红色石蕊试纸检验,试纸变蓝色证明生成了氨气,原溶液中含铵根离子,
故答案为:过滤;取少许溶液于试管中,加入浓氢氧化钠溶液加热,用湿润的红色石蕊试纸检验,试纸变蓝色证明生成了氨气,原溶液中含铵根离子;
(3)由题目看出在Ⅲ反应中生成的K2SO4为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度,故答案为:降低K2SO4的溶解度,有利于K2SO4析出;
(4)反应I中Fe2+完全沉淀后溶液中亚铁离子浓度小于10-5mol/L,FeCO3的Ksp=c(Fe2+)c(CO32-)=2×10-11,得到溶液中c(CO32-)=2×10-6mol/L,
故答案为:2×10-6mol/L;
(5)空气中煅烧FeCO3生成铁红,反应的方程式为4FeCO3 +O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3 +4CO2,
故答案为:4FeCO3 +O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3 +4CO2;
(6)NH4Cl水解使溶液呈酸性,反应离子方程式为NH4++H2O?NH4•H2O+H+;铁锈(Fe2O3)在酸性条件下生成三价铁离子,反应离子方程式为Fe2O3+6H+=2Fe3++3H2O;
故答案为:NH4++H2O?NH4•H2O+H+、Fe2O3+6H+=2Fe3++3H2O.
点评 本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握实验的流程和制备原理,题目难度中等.

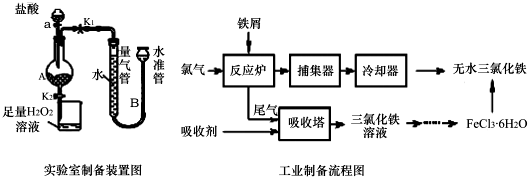
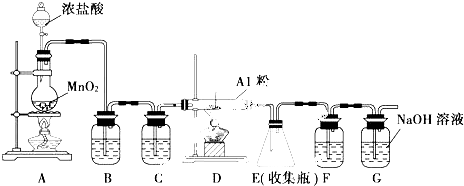
已知:(1)无水FeCl3熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变.
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
样品中氯化铁的质量分数$\frac{162.5cV}{m}$%.
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
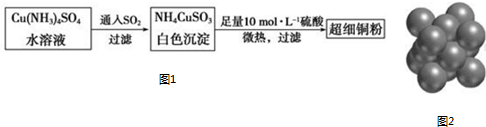
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).