题目内容
11.图为工业合成氨生产简易流程图: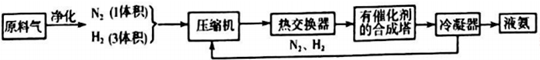
回答下列问题:
(1)合成氨所需的氮气来源于空气;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
(2)在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;
上述流程中热交换器的作用是热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气.从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨.为提高原料的利用率,通常采取的措施是将N2,H2循环利用.
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快.②该温度下催化剂的活性较大.
(4)氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):2NH3+CO2$\stackrel{加热加压}{→}$H2NCOONH4.
②氨基甲酸铵受热分解为尿素与水:H2NCOONH4$\stackrel{△}{→}$CO(NH2)2+H2O.
(5)新法合成氨常采用电解法合成.即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率.新法合成氨所用的电解质能传导H+,则阴极的电极反应式为N2+6H++6e-═2NH3.
分析 (1)根据空气中含有大量的氮气分析;根据反应的方程式结合表中数据列方程式计算;
(2)根据合成氨在催化剂高温高压条件下进行,则在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;热交换器的作用是充分利用能源,降低成本;物质的循环使用可以节约原料,提高利用率;
(3)采用400℃-500℃的温度,根据合成氨为放热反应,对氨的合成不利,但可考虑催化剂的活性增大反应速率;
(4)根据反应前后原子守恒书写化学方程式;
(5)电解池的阴极发生得电子的还原反应,总反应式减去阳极电极反应式,即为阴极电极反应式.
解答 解:(1)因为空气中含有大量的氮气,并且成本很低,所以合成氨所需的氮气来源于空气;
设反应消耗的H2O为xmol,O2为ymol,则根据CH4(g)+H2O(g)=CO(g)+3H2(g)和2CH4(g)+O2(g)=2CO(g)+4H2(g),
得$\left\{\begin{array}{l}{x+2y=25}\\{3x+4y=60}\end{array}\right.$
x=10,y=7.5
V(O2):V(N2)=$\frac{2.5+7.5}{15}$=2:3,
故答案为:空气;2:3;
(2)因为合成氨的原科气中混有的杂质可能使催化剂中毒,所以在合成氨的原科气中混有的杂质必须除去;热交换器的作用是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气,充分利用能源,降低成本;未反应的N2和H2,可以循环使用,这样循环可以提高原料气的利用率,
故答案为:防止催化剂中毒;热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气;将N2,H2循环利用;
(3)采用400℃-500℃的温度,根据合成氨为放热反应,对氨的合成不利,但该温度范围内反应速率较快,主要考虑催化剂的活性较大,
故答案为:该温度下催化剂的活性较大;
(4)①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4),则发生的化学方程式为:2NH3+CO2$\stackrel{加热加压}{→}$H2NCOONH4,
故答案为:2NH3+CO2$\stackrel{加热加压}{→}$H2NCOONH4;
②氨基甲酸铵受热分解为尿素与水,则发生的化学方程式为:H2NCOONH4$\stackrel{△}{→}$CO(NH2)2+H2O,故答案为:H2NCOONH4$\stackrel{△}{→}$CO(NH2)2+H2O;
(5)总反应式为N2+3H2=2NH3,阳极的电极反应为3H2-6e-═6H+,总反应式减去阳极电极反应式即为阴极电极反应式,所以阴极电极反应式为:N2+6H++6e-═2NH3,
故答案为:N2+6H++6e-═2NH3.
点评 本题考查学生合成氨的原理以及应用等知识,侧重于学生分析能力和问题解决能力的考查,注重于化学对生活、生产的指导,难度中等.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| A. | 液氨中含有H2O,NH3•H2O,NH3,NH4+,NH2-等微粒 | |
| B. | 液氨中c(NH4+)•c(NH2-)是一个随温度升高而减小的常数 | |
| C. | 液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-) | |
| D. | 任何温度下,只要不加入其他物质,液氨中c(NH4+)和c(NH2-)一定相等 |
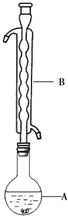 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过、后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(4)为了测产品的纯度,称取7.40g产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.00 | 30.82 |
| 第二次 | 0.00 | 30.80 |
| 第三次 | 0.00 | 30.78 |
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
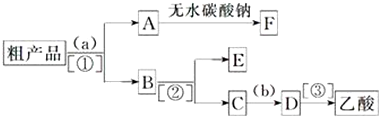
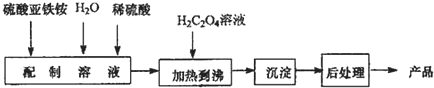
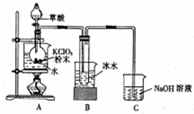 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
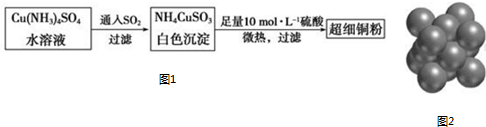
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).