题目内容
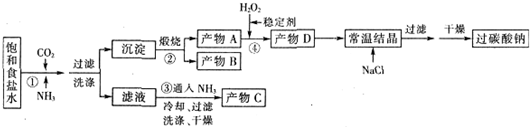
15.过碳酸钠(Na2CO3•3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如图所示.已知:2Na2CO3+3H2O2=2Na2CO3•3H2O2△H<0;回答下列问题:
(1)下列物质可使过碳酸钠较快失效的是(填序号)ABC.
A.FeCl3溶液 B.H2S C.稀硫酸 D.NaHCO3溶液
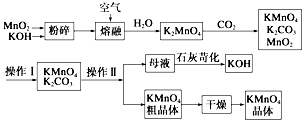
(2)反应①应先通入的气体是氨气.写出反应①的化学方程式NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓(写总反应)
(3)加入NaCl的作用是降低2Na2CO3•3H2O2的溶解度,析出更多晶体.
(4)该生产流程中可循环使用的物质是CO2(填化学式).
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,该步操作名称是晶体的洗涤;进行该操作的方法是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次.
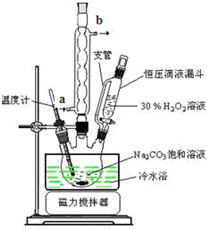
(6)实验室利用图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是使液体顺利流下,冷凝管应从a处进水.
(7)由实验测定反应温度对产物的影响如表:根据表数据,你认为反应最佳的温度选择的范围是15~20℃.
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
分析 氨气易溶于水,与二氧化碳、氯化钠溶液反应生成碳酸氢钠和氯化铵,反应方程式为NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓;过滤得到滤液和沉淀,沉淀为NaHCO3,加热碳酸氢钠分解生成碳酸钠(A)、水和二氧化碳,碳酸钠与双氧水反应生成过碳酸钠,然后向溶液中加入氯化钠固体、常温结晶、过滤、干燥得到过碳酸钠;
(1)过碳酸钠具有碳酸钠和过氧化氢的性质,能与比碳酸强的酸反应、能发生分解反应、能被强氧化剂氧化;
(2)氨气易溶于水,二氧化碳溶解性较氨气弱,应该先通入溶解性大的气体;
(3)加入NaCl能降低过碳酸钠溶解度;
(4)碳酸氢钠分解生成碳酸钠、水和二氧化碳;
(5)从溶液中过滤出固体后,需要洗涤沉淀;
(6)恒压滴液漏斗能保持压强恒定;
冷凝管内水采用逆流方法;
(7)根据表数据可知温度超过20℃后,活性氧百分含量和产率均降低.
解答 解:氨气易溶于水,与二氧化碳、氯化钠溶液反应生成碳酸氢钠和氯化铵,反应方程式为NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓;过滤得到滤液和沉淀,沉淀为NaHCO3,加热碳酸氢钠分解生成碳酸钠(A)、水和二氧化碳,碳酸钠与双氧水反应生成过碳酸钠,然后向溶液中加入氯化钠固体、常温结晶、过滤、干燥得到过碳酸钠;
(1)过碳酸钠具有碳酸钠和过氧化氢的性质,能与比碳酸强的酸反应、能发生分解反应、能被强氧化剂氧化,
A.FeCl3溶液具有氧化性,能氧化双氧水而导致过碳酸钠失效,故A正确;
B.H2S具有还原性,能将双氧水还原而使过碳酸钠失效,故B正确;
C.稀硫酸酸性大于碳酸,所以稀硫酸和碳酸钠反应而失效,故C正确;
D.NaHCO3溶液和碳酸钠、双氧水都不反应,所以不能使过碳酸钠失效,故D错误;
故选ABC;
(2)氨气易溶于水,二氧化碳溶解性较氨气弱,应该先通入溶解性大的气体,所以应该先通入氨气,反应方程式为NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓,
故答案为:氨气;NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓;
(3)加入NaCl能降低过碳酸钠溶解度而析出更多的过碳酸钠,
故答案为:降低2 Na2CO3•3H2O2的溶解度,析出更多晶体;
(4)反应①中二氧化碳参加反应、②中生成二氧化碳,所以能循环利用的物质是CO2,故答案为:CO2;
(5)从溶液中过滤出固体后,需要洗涤沉淀,其操作方法是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次,
故答案为:晶体的洗涤;沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次;
(6)恒压滴液漏斗能保持压强恒定,因此恒压滴液漏斗中支管的作用是使液体顺利流下.冷凝管应从下端进水,即a处进水上端出水,故答案为:使液体顺利流下;a;
(7)根据表数据可知温度超过20℃后,活性氧百分含量和产率均降低,所以反应最佳的温度选择的范围是15~20℃,故答案为:15~20℃.
点评 本题考查物质制备,为高频考点,涉及数据分析、实验操作、氧化还原反应等知识点,明确元素化合物性质及其性质差异性、实验操作规范性等是解本题关键,注意实验操作规范性,题目难度中等.

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
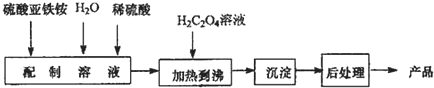
三新快车金牌周周练系列答案(2)若要测定此反应的化学反应速率,最方便的测定方法是测定溶液紫红色褪色时间;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥$\frac{5}{2}$.
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
| 编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
 某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
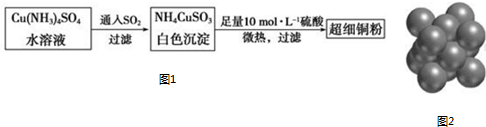
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).