题目内容
14.无水三氯化铁是有机合成的催化剂,为棕黄色固体,易潮解产生白雾,200℃左右时升华.实验室可用氯气与铁反应制备无水三氯化铁,下图是甲组学生设计的制备装置.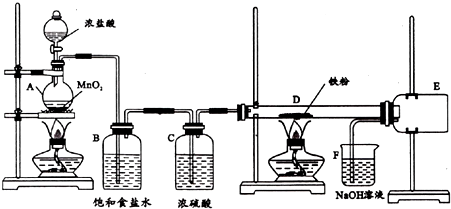
(1)仪器A的名称是圆底烧瓶;装置B的作用是除去Cl2中的HCl
(2)装置D中发生反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3;装置D可观察到的现象是玻璃管中产生棕黄色的烟,铁粉逐渐减少
(3)装置D与E之间不用玻璃导气管连接,原因是若用玻璃导管,FeCl3易在导管口冷凝造成堵塞; 点燃装置D处酒精灯的时机是待D装置的玻璃管内充满黄绿色气体时,才点燃酒精灯.
(4)装置F的作用是吸收尾气防止空气污染;可能发生的反应有Cl2+2OH-=Cl-+ClO-+H2O(用两个离子方程式表示).
(5)与甲组设计对比,乙组同学去掉了装置C.实验时无论怎样改变铁粉的用量,装置D中都有少量的固体残留.乙组同学对残留固体的成分作如下两种推测:Ⅰ可能是氯化铁;Ⅱ可能是Fe3O4,其依据是(用化学方程式表示)3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,验证该推测的实验方法是取少量固体,用铁丝靠近,若发生吸引,则推测成立.
分析 (1)根据装置图判断;氯气在饱和食盐水中溶解度很小,HCl易溶;
(2)在加热条件下,Fe与氯气反应生成三氯化铁;三氯化铁为棕黄色固体;
(3)FeCl3冷却凝结为固体,会造成堵塞;先排除装置中的空气再加热;
(4)氯气为有毒气体,用氢氧化钠溶液吸收;
(5)没有用浓硫酸干燥,会有水蒸气,水蒸气与Fe会反应生成四氧化三铁;四氧化三铁有磁性.
解答 解:(1)由装置图可知,仪器A的名称是圆底烧瓶;制备的气体先通过饱和食盐水,氯气在饱和食盐水中溶解度很小,HCl易溶,所以饱和食盐水用于除去Cl2中的HCl;
故答案为:圆底烧瓶;除去Cl2中的HCl;
(2)装置D中,在加热条件下,Fe与氯气反应生成三氯化铁,其反应的方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3;反应生成的三氯化铁为棕黄色固体,所以装置D可观察到的现象是玻璃管中产生棕黄色的烟,铁粉逐渐减少;
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3;玻璃管中产生棕黄色的烟,铁粉逐渐减少;
(3)玻璃导管的体积较小,若用玻璃导管,FeCl3冷却凝结为固体,FeCl3易在导管口冷凝造成堵塞;装置中的空气在加热条件下能与Fe反应生成四氧化三铁,所以应该先排除装置中的空气再加热,即待D装置的玻璃管内充满黄绿色气体时,才点燃酒精灯;
故答案为:若用玻璃导管,FeCl3易在导管口冷凝造成堵塞;待D装置的玻璃管内充满黄绿色气体时,才点燃酒精灯;
(4)氯气为有毒气体会污染空气,要进行尾气处理,所以用氢氧化钠溶液吸收,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:吸收尾气防止空气污染;Cl2+2OH-=Cl-+ClO-+H2O;
(5)没有用浓硫酸干燥,氯气中含有水蒸气,在加热条件下,水蒸气与Fe会反应生成四氧化三铁,所以II可能是Fe3O4;其反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;四氧化三铁有磁性,若要检验是否有四氧化三铁可以用铁丝,其操作为取少量固体,用铁丝靠近,若发生吸引,则推测成立;
故答案为:Fe3O4;3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;取少量固体,用铁丝靠近,若发生吸引,则推测成立.
点评 本题考查了制备方案的设计,题目难度中等,设计实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等知识,明确实验目的为解答关键,注意掌握制备方案的设计方法,试题培养了学生的化学实验能力.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | ②③④ | B. | ②④ | C. | ①③④ | D. | ①②④ |
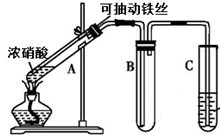 某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
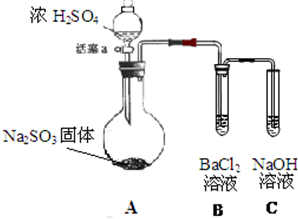 某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):
某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):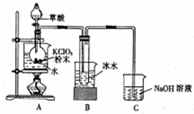 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
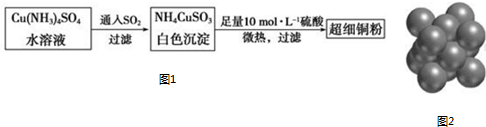
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).