题目内容
1.下列反应为吸热反应的有①④⑥.①CaCO3分解 ②钠与水反应 ③硫在O2中燃烧 ④CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO ⑤CaO+H2O═Ca(OH)2⑥C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2 ⑦N2与H2合成NH3 ⑧NaOH和CH3COOH的反应.
分析 根据常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应等;
常见的吸热反应有:绝大数分解反应,以C、氢气和CO为还原剂的氧化还原反应(如C和CO2),八水合氢氧化钡与氯化铵的反应.
解答 解:①CaCO3分解是分解反应,故为吸热反应,故正确;
②钠与水反应是金属和水的反应,故为放热反应,故错误;
③所有的燃烧均为放热反应,故硫在O2中燃烧放热,故错误;
④CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO是吸热反应,故正确;
⑤CaO+H2O═Ca(OH)2是化合反应,故为放热反应,故错误;
⑥C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2 是以碳为还原剂的氧化还原反应,故为吸热反应,故正确;
⑦N2与H2合成NH3 是化合反应,故为放热反应,故错误;
⑧NaOH和CH3COOH的反应是酸碱中和反应,故为放热反应,故错误.
故答案为:①④⑥.
点评 本题考查吸热反应和放热反应,难度不大,明确常见的吸热反应和放热反应是解题的关键.

练习册系列答案
相关题目
11.有关能量的判断或表示方法正确的是( )
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
12.四种因素:①温度和压强 ②所含微粒数 ③微粒本身大小 ④微粒间的距离,其中对气态物质体积有显著影响的是( )
| A. | ②③④ | B. | ②④ | C. | ①③④ | D. | ①②④ |
9.与纯水的电离相似,液氨中存在着微弱的电离:2NH3?NH4++NH2-,以下叙述中正确的是( )
| A. | 液氨中含有H2O,NH3•H2O,NH3,NH4+,NH2-等微粒 | |
| B. | 液氨中c(NH4+)•c(NH2-)是一个随温度升高而减小的常数 | |
| C. | 液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-) | |
| D. | 任何温度下,只要不加入其他物质,液氨中c(NH4+)和c(NH2-)一定相等 |
16.下列叙述正确的是( )
| A. | 任何浓度的溶液都可以用pH来表示其酸碱性的强弱 | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-a mol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)•c(OH-)=1×10-14 |
6.工业上以CuFeS2为原料冶炼铜的主要反应为①2CuFeS2+4O2═Cu2S+3SO2+2FeO (炉渣);②2Cu2S+3O2═2Cu2O+2SO2;③2Cu2O+Cu2S=6Cu+SO2↑.下列说法错误的是( )
| A. | 由 1 mol CuFeS2 生成 1mol Cu,共消耗 2.75 molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
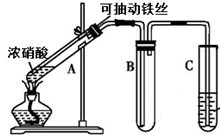 某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
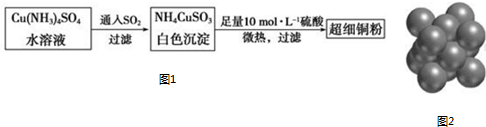
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).