题目内容
15. 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | Fe3+、H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
②计算原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
分析 (1)根据产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,一开始无沉淀,溶液中一定含有H+,能够与氢离子反应的离子不能存在;加NaOH有气体放出,则推断溶液中一定含有NH4+,沉淀最后完全消失,则溶液中只含有Al3+,不含铁离子,不同金属阳离子灼烧呈现不同的焰色,据此解答;
(2)碘离子与溴离子的还原性强弱顺序为:I->Br-,加入氯气2.8L时溶液中I-amol,则说明通入2.8L Cl2只发生:Cl2+2I-═I2+2Cl-,2.8L变成5.6L,消耗2.8L Cl2的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,发生:Cl2 +2Br-═Br2+2Cl-,Cl2+2I-═I2+2Cl-,根据反应方程式计算.
解答 解:(1)从产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,开始时没有沉淀生成,说明溶液中氢离子,则一定没有ClO-、AlO2-;随后出现沉淀,且沉淀完全溶解了,说明沉淀是氢氧化铝,溶液中一定含有铝离子,而无铁离子;氢氧化铝溶解前生成了气体,该气体一定是氨气,故溶液中一定含有铵离子;不能确定是否含有钾离子,可以通过灼烧溶液,透过蓝色的钴玻璃观察焰色确定钾离子的存在;
故答案为:K+;焰色反应;ClO-、AlO2-;
(2)①由于碘离子与溴离子的还原性:I->Br-,加入氯气2.8L时溶液中I-amol,2.8L变成5.6L,消耗2.8LCl2的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,发生:Cl2 +2Br-═Br2+2Cl-,Cl2+2I-═I2+2Cl-,Br-消耗0.1mol,需要氯气0.05mol,则说明开始通入2.8LCl2只发生:Cl2+2I-═I2+2Cl-,此时n(Cl2)=$\frac{2.8L}{22.4L/mol}$=0.125mol,消耗n(I-)=2×0.125mol=0.25mol,生成n(Cl-)=2×0.125mol=0.25mol,此时n(Br-)=1.5mol,则说明原溶液中n(Br-)=1.5mol;
故答案为:Cl2+2I-═I2+2Cl-;
②通入氯气2.8L时,n(Br-)=1.5mol,所以原溶液中n(Br-)=1.5mol;
n(Cl-)=0.125mol×2=0.25mol,n(I-)=0.25mol,故原溶液中n(Cl-)=1.25mol-0.25mol=1mol;
通入氯气5.6L时,n(Br-)=1.5mol-1.4mol=0.1mol,n(I-)=0.25mol-0.1mol=0.15mol,故原溶液中n(I-)=0.25mol+0.15mol=0.4mol;
故原溶液中Cl-、Br-、I-的物质的量浓度之比为:1:1.5:0.4=10:15:4;
故答案为:10:15:4.
点评 本题考查离子的判断和有关计算,准确分析图标数据是解题关键,题目难度中等,注意根据离子的还原性以及表中数据判断反应的程度,结合方程式计算.

 学业测评一课一测系列答案
学业测评一课一测系列答案①向饱和碳酸钠溶液中通入过量的CO2
②向NaAlO2胶体中逐滴加入过量的稀盐酸
③氢氧化钡溶液中缓慢通入二氧化硫至过量
④向硅酸钠溶液中逐滴加入过量的盐酸.
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 标准状况下,0.4 g D2中所含中子的数目为0.2NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 标准状况下,盛有11.2 L NO2的密闭容器中氮原子数为0.5NA |
| A. | 150mL1mol/L的氯化钠溶液 | B. | 75mL2mol/L的氯化铵溶液 | ||
| C. | 150mL3mol/L的氯化钾溶液 | D. | 75mL1mol/L的氯化亚铁溶液 |
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
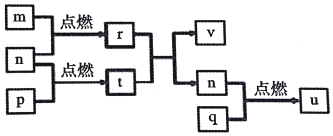 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:W>Z>Y>X | |
| B. | Z分别与Y、W组成的化合物中化学键类型可能相同 | |
| C. | v能抑制水的电离而u能促进水的电离 | |
| D. | 粘有q的试管可用酒精洗涤 |
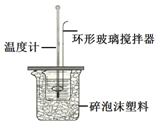 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)Ⅰ.某实验小组用0.50mol/L NaOH溶液和0.50mol/L盐酸溶液进行中和热的测定,实验中要配制250mL0.50mol/L的NaOH溶液,则需要NaOH固体质量为5.0g;
Ⅱ.(1)该图中环形玻璃搅拌棒的作用是使酸与碱混合均匀,充分反应;
(2)取50mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如表:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
(近似认为0.50mol/L NaOH溶液和0.50mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c0=4.2J/(g•℃),Q=-c0×m×△t)
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是实验装置保温、隔热效果差等.

 .
. .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答: