题目内容
6.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 标准状况下,0.4 g D2中所含中子的数目为0.2NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 标准状况下,盛有11.2 L NO2的密闭容器中氮原子数为0.5NA |
分析 A.质量转化为物质的量,结合1个乙烷分子含有6个C-H和1个C-C,共7个共价键;
B.质量转化为物质的量,结合1个D2中含有2个中子解答;
C.氨水溶液,水、一水合氨都能电离产生氢氧根离子;
D.二氧化氮与四氧化二氮存在NO2?N2O4;
解答 解:A.常温常压下,30 g乙烷气体中所含有的共价键数目为$\frac{30g}{30g/mol}$×7×NA=7NA,故A错误;
B.标准状况下,0.4 g D2中所含中子的数目为$\frac{0.4g}{8g/mol}$×2×NA=0.2NA,故B正确;
C.氨水溶液,水、一水合氨都能电离产生氢氧根离子,则常温下,1 L pH=12的氨水溶液中,氢氧根离子数目为0.01NA,含有NH4+数目小于0.01NA,故C错误;
D.二氧化氮与四氧化二氮存在NO2?N2O4,则标准状况下,盛有11.2 L NO2的密闭容器中氮原子数大于0.5NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
14.下列有关电解质溶液的叙述正确的是( )
| A. | 升高温度时,HF的Ka增大,水的Kw不变 | |
| B. | 向Mg(OH)2悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大 | |
| C. | 常温下,0.lmol/LNH4Cl 溶液的 pH>7 | |
| D. | 0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
11.下列实验操作中,错误的是( )
| A. | 倾倒液体时试剂瓶标签面向手心. | |
| B. | 玻璃棒蘸取溶液滴到放在表面皿上湿润的pH试纸上. | |
| C. | 用HCl溶液洗涤并灼烧铂丝后,再进行焰色反应. | |
| D. | KOH溶液保存在带磨口玻璃塞的试剂瓶中. |
18.下列陈述正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 氢氧化铝可与盐酸反应 | 氢氧化铝可用于治疗胃酸过多 |
| D | 冷的浓硝酸与铁不发生反应 | 可以用铁槽车储运浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
15.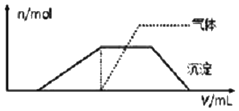 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.不能确定是否含有的阳离子有K+,要确定其存在可补充做实验的是肯定不存在的阴离子有ClO-、AlO2-
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为Cl2+2I-═I2+2Cl-;
②计算原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | Fe3+、H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
②计算原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,反应的化学方程式为2N?M.
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,反应的化学方程式为2N?M.
 ;
;