题目内容
12.设NA表示阿伏伽德罗常数的值,下列结论中正确的是( )| A. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 粗铜精炼时,当阳极质量减少6.4 g时,电路中转移的电子数一定不是0.2NA | |
| C. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| D. | 200 mL 0.5 mol•L-1 Na2CO3溶液中,由于CO32-水解,所以阴离子的数目小于0.1NA |
分析 A.溶液体积未知;
B.在粗铜的电解精炼中,阳极上放电的除了铜,还有比铜活泼的金属;
C.铜与浓硫酸反应,与稀硫酸不反应;
D.碳酸根离子水解生成碳酸氢根离子和氢氧根离子.
解答 解:A.依据n=CV可知,溶液体积未知,无法计算氢氧根离子数目,故A错误;
B.在粗铜的电解精炼中,阳极上放电的除了铜,还有比铜活泼的金属,故当阳极的质量减少6.4g时,电路中转移的电子不一定是0.2NA个,故B正确;
C.铜只能与浓硫酸反应,与稀硫酸不反应,故0.2mol硫酸不能反应完全,故生成的二氧化硫的分子个数小于0.1NA个,故C错误;
D.200 mL 0.5 mol•L-1 Na2CO3溶液中,由于CO32-水解,所以阴离子的数目大于0.1NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数,明确电解法精炼铜原理、盐类水解规律是解题关键,注意浓硫酸与铜反应,稀硫酸与铜不反应,题目难度不大.

练习册系列答案
相关题目
3.一定温度时,KW=1×10-12 mol2•L-2,对纯水的叙述正确的是( )
| A. | pH=6,显弱酸性 | B. | [H+]=10-6mo1•L-1,溶液为中性 | ||
| C. | [OH-]=10-6mo1•L-1,溶液为碱性 | D. | 温度不变稀释10倍,pH=7 |
20.下列离子方程错误的是( )
| A. | 碳酸氢钠溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 向氯化铁溶液中投入铜粉 Cu+Fe3+═Fe2++Cu2+ | |
| C. | 少量的二氧化碳通入次氯酸钙溶液 Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓ | |
| D. | 铜与稀硝酸反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
7.“细节决定成败”化学实验中尤其要注重细节.下列实验操作或设计正确的是( )
| A. | 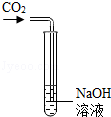 检验生成的气体是CO2 | B. | 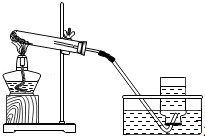 加高锰酸钾制氧气 | ||
| C. | 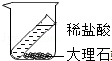 验证质量守恒定律 | D. | 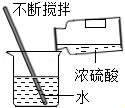 实验室稀释浓硫酸 |
17.X、Y、Z 均为短周期元素,X、Y 处于同一周期,X、Z 的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 气态氢化物的稳定性:HX>HZ | B. | 原子半径:Y>X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 元素的最高化合价:Z>X>Y |
4.下列有关变化过程的叙述不正确的是( )
| A. | 从海水中提取溴必须通过化学反应才能实现 | |
| B. | 用侯氏制碱法制纯碱必须通过化学反应才能实现 | |
| C. | 用“地沟油”纯化生产“生物燃油”的过程发生的是化学变化 | |
| D. | 石墨在高温高压下转变为金刚石是化学变化 |
1.下列关于溶液的叙述正确的是( )
| A. | 将28.4g Na2SO4溶于水配成1000mL溶液,溶液中c (Na+)的物质的量浓度为0.2mol/L | |
| B. | 80 mL 1 mol•L-1氯化钠溶液中的c (Na+)与40 mL 1 mol•L-1碳酸钠溶液中的c (Na+) 相等 | |
| C. | 0.5 mol•L-1NaCl和0.5mol•L-1Na2SO4两溶液相比较,Na+的物质的量之比为1:2 | |
| D. | 4 mol•L-1的NaCl溶液稀释成100 mL 0.2molL-1的NaCl溶液,需4 mol•L-1的NaCl溶液的体积为5.0mL |
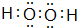 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.