题目内容
某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升.若用同样的铝片投入相同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与相同浓度的硫酸铜溶液在短时间内不反应的原因可能是 (填序号).
A.铝与Cl-反应,铝与SO42-不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是 .
(3)放出的气体是 ,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 .
(4)某同学通过其他的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是 .
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片.
(1)铝与氯化铜溶液能迅速反应,而与相同浓度的硫酸铜溶液在短时间内不反应的原因可能是
A.铝与Cl-反应,铝与SO42-不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是
(3)放出的气体是
(4)某同学通过其他的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片.
考点:铝的化学性质
专题:几种重要的金属及其化合物
分析:(1)金属铝的表面有一层致密的氧化物薄膜,结合氯化铝和硫酸铝阴离子的不同来分析;
(2)金属铝能置换铜盐中的金属铜;
(3)金属铝也能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快;
(4)根据原电池原理能加速金属的腐蚀以及氧化铝能和强碱反应的性质来解答.
(2)金属铝能置换铜盐中的金属铜;
(3)金属铝也能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快;
(4)根据原电池原理能加速金属的腐蚀以及氧化铝能和强碱反应的性质来解答.
解答:
解:(1)金属铝的表面有一层致密的氧化物薄膜,氯化铝和硫酸铝阴离子的不同,氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能,故答案为:D;
(2)金属铜呈暗红色,金属铝能置换铜盐中的金属铜,即2Al+3Cu2+=3Cu+2Al3+,故答案为:Cu;
(3)氯化铜和硫酸铜均是强酸弱碱盐,水解显酸性,金属铝能和酸反应产生氢气,Al3++3H2O Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑,金属铝能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快,开始阶段产生气体的速率不断加快的原因是其中某一个或多个因素的结果,
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑,金属铝能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快,开始阶段产生气体的速率不断加快的原因是其中某一个或多个因素的结果,
故答案为:氢气;反应放热以及形成原电池;
(4)A、用砂纸擦去铝片表面的氧化膜,再投入硫酸铜溶液中,形成铝铜原电池,能加速金属的腐蚀,故A正确;
B、氧化铝能和强碱反应,然后把铝片投入投入硫酸铜溶液中,形成铝铜原电池,能加速金属的腐蚀,故B正确;
C、硫酸铜和氢氧化钠发生复分解反应生成氢氧化铜沉淀和硫酸钠,再投入铝片不反应,故C错误;
D、在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中,会形成铜、铝、硫酸铜原电池,金属铝做负极,加快反应速率,故D正确.
故答案为:ABD.
(2)金属铜呈暗红色,金属铝能置换铜盐中的金属铜,即2Al+3Cu2+=3Cu+2Al3+,故答案为:Cu;
(3)氯化铜和硫酸铜均是强酸弱碱盐,水解显酸性,金属铝能和酸反应产生氢气,Al3++3H2O
 Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑,金属铝能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快,开始阶段产生气体的速率不断加快的原因是其中某一个或多个因素的结果,
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑,金属铝能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快,开始阶段产生气体的速率不断加快的原因是其中某一个或多个因素的结果,故答案为:氢气;反应放热以及形成原电池;
(4)A、用砂纸擦去铝片表面的氧化膜,再投入硫酸铜溶液中,形成铝铜原电池,能加速金属的腐蚀,故A正确;
B、氧化铝能和强碱反应,然后把铝片投入投入硫酸铜溶液中,形成铝铜原电池,能加速金属的腐蚀,故B正确;
C、硫酸铜和氢氧化钠发生复分解反应生成氢氧化铜沉淀和硫酸钠,再投入铝片不反应,故C错误;
D、在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中,会形成铜、铝、硫酸铜原电池,金属铝做负极,加快反应速率,故D正确.
故答案为:ABD.
点评:本题考查铝的化学性质,为高频考点,把握金属与酸、盐溶液的置换反应为解答的关键,涉及化学反应速率、原电池等,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
向容积为2L的密闭容器中充入2mol A气体和1mol B气体,一定条件下发生如下反应2A(g)+B(g)?3C(g),经2s后达到平衡,测得C的浓度为0.6mol/L.下列说法中不正确的是( )
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
下列说法不正确的是( )
| A、同位素示踪法是科学家经常使用的研究化学反应历程的手段之一 |
| B、乙烷在1H核磁共振谱中只会在一个位置上出现特征峰 |
| C、红外光谱能够快速、微量、精确的测定相对分子质量 |
| D、“基团理论”认为有机化学中的“基”是一成不变的,这种说法是不正确的 |
下列各组原子中,彼此化学性质一定相似的是( )
| A、2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子 |
| B、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
| C、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| D、最外层都只有一个电子的X、Y原子 |
下列关于Na2CO3和NaHCO3的性质的比较中,正确的是( )
| A、热稳定性:Na2CO3>NaHCO3 |
| B、常温时在水中的溶解度:NaHCO3>Na2CO3 |
| C、与稀盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
| D、等质量的固体与足量盐酸反应放出CO2的质量:Na2CO3>NaHCO3 |
用惰性电极电解2L、1mol/L的CuSO4溶液,在电路中通过0.5mol电子后,调换正、负极,电路中又通过了1mol电子,此时溶液中H+的浓度(假设溶液体积不变)是( )
| A、1.5mol/L |
| B、0.75mol/L |
| C、0.5mol/L |
| D、0.25mol/L |
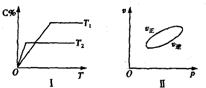 可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )| A、T1<T2,Q>0 |
| B、增大压强,物质B的转化率减小 |
| C、至反应达平衡时,混合气体的密度会变化 |
| D、a+b>c+d |
