题目内容
某温度下,反应2CH3OH(g)?CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
下列说法不正确的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
| A、CH3OH的起始浓度为1.64 mol/L |
| B、此时逆反应速率小于正反应速率 |
| C、平衡时,CH3OH的浓度为0.04 mol/L |
| D、平衡时,CH3OH的转化率小于90% |
考点:化学平衡的计算,化学平衡建立的过程
专题:化学平衡专题
分析:A、甲醇起始量浓度等于变化浓度和剩余浓度的和;
B、依据浓度商和平衡常数比较分析反应进行的方向;
C、依据平衡常数和化学平衡三段式列式计算得到;
D、依据计算得到甲醇的变化浓度,进而计算甲醇的转化率.
B、依据浓度商和平衡常数比较分析反应进行的方向;
C、依据平衡常数和化学平衡三段式列式计算得到;
D、依据计算得到甲醇的变化浓度,进而计算甲醇的转化率.
解答:
解:A、根据反应:2CH3OH(g)?CH3OCH3(g)+H2O(g),当甲醚和水的浓度是0.6mol/L,所以消耗的甲醇是1.2mol/L,即甲醇起始量浓度为0.44+1.2=1.64mol/L,故A正确;
B、表中数据分析计算Q=
=1.86<400,说明反应正向进行,v正>v逆,故B正确;
C、设转化的甲醇浓度为x
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量( mol/L) 1.64 0 0
变化量(mol/L) x 0.5x 0.5x
平衡量(mol/L) 1.64-x 0.5x 0.5x
则
=400,解得x=1.6mol/L,所以平衡时,CH3OH的浓度为1.64mol/L-1.6mol/L=0.04mol/L,故C正确;
D、达到平衡时,甲醇的转化率=
≈98%,故D错误.
故选D.
B、表中数据分析计算Q=
| 0.6×0.6 |
| 0.442 |
C、设转化的甲醇浓度为x
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量( mol/L) 1.64 0 0
变化量(mol/L) x 0.5x 0.5x
平衡量(mol/L) 1.64-x 0.5x 0.5x
则
| (0.5x)2 |
| (1.64-x)2 |
D、达到平衡时,甲醇的转化率=
| 1.6mol/L |
| 1.64mol/L |
故选D.
点评:本题考查了化学平衡常数的计算应用,平衡常数随温度变化,化学平衡三段式计算方法的应用,题目难度中等.

练习册系列答案
相关题目
一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol?L-1.下列有关判断不正确的是( )
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |
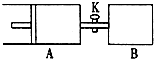 如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )
如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )| A、反应速率:V(B)<V(A) |
| B、A容器中X转化率为20% |
| C、平衡时的压强:P(B)=2P(A) |
| D、若打开K,则达到新的化学平衡时,A的体积为2.6aL |
把6mol A气体和5mol B气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L?min),下列说法中正确的是( )
| A、A的平均反应速率为0.15mol/(L?min) |
| B、恒温达到平衡时容器内压强为开始时的85% |
| C、B的转化率为10% |
| D、平衡时A的浓度为0.8mol/L |
向容积为2L的密闭容器中充入2mol A气体和1mol B气体,一定条件下发生如下反应2A(g)+B(g)?3C(g),经2s后达到平衡,测得C的浓度为0.6mol/L.下列说法中不正确的是( )
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
下列说法不正确的是( )
| A、同位素示踪法是科学家经常使用的研究化学反应历程的手段之一 |
| B、乙烷在1H核磁共振谱中只会在一个位置上出现特征峰 |
| C、红外光谱能够快速、微量、精确的测定相对分子质量 |
| D、“基团理论”认为有机化学中的“基”是一成不变的,这种说法是不正确的 |
 实验室用NaCl固体配制0.40mol/L的NaCl溶液250mL.
实验室用NaCl固体配制0.40mol/L的NaCl溶液250mL.
 ;△H1
;△H1