题目内容
100mL 2mol/L的硫酸和过量的锌反应,为加快反应速率,但又不影响生成氢气的总量,可采取的措施是( )
| A、升高温度 |
| B、改用含有少量杂质铜的锌 |
| C、改用98%的浓硫酸 |
| D、加水 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:常见影响反应速率的因素有浓度、温度、压强、催化剂以及固体表面积等,影响硫酸和锌反应的速率的因素有浓度、温度和固体的表面积大小,加快反应速率,应使浓度增大、温度升高或增大固体表面积,不影响生成氢气的总量,则硫酸的物质的量应不变,以此解答.
解答:
解:A.升高温度,活化分子百分数增加,反应速率增大,且氢气的总量不变,故A正确;
B.改用含有少量杂质铜的锌,可形成原电池发反应,加快反应速率,故B正确;
C.浓硫酸与锌反应生成二氧化硫气体,故C错误;
D.加水稀释,浓度减小,反应速率减小,故D错误.
故选AB.
B.改用含有少量杂质铜的锌,可形成原电池发反应,加快反应速率,故B正确;
C.浓硫酸与锌反应生成二氧化硫气体,故C错误;
D.加水稀释,浓度减小,反应速率减小,故D错误.
故选AB.
点评:本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
下列关于有机物的说法错误的是( )
A、由CH2=CHCOOCH3合成的聚合物为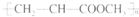 |
| B、溴乙烷与NaOH乙醇溶液共热生成乙烯 |
| C、装饰材料中的甲醛和芳香烃会造成居室污染 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
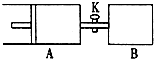 如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )
如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )| A、反应速率:V(B)<V(A) |
| B、A容器中X转化率为20% |
| C、平衡时的压强:P(B)=2P(A) |
| D、若打开K,则达到新的化学平衡时,A的体积为2.6aL |
向容积为2L的密闭容器中充入2mol A气体和1mol B气体,一定条件下发生如下反应2A(g)+B(g)?3C(g),经2s后达到平衡,测得C的浓度为0.6mol/L.下列说法中不正确的是( )
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)?xC(g)+D(s),向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C和2mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是( )
| A、若平衡时,甲、乙两容器中A的物质的量不相等,则x=3 |
| B、平衡时,甲、乙两容器中A、B的物质的量之比不相等 |
| C、平衡时甲中A的体积分数为40% |
| D、若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 |
“春蚕到死丝方尽”,这里“丝”的主要成分是( )
| A、维生素 | B、蛋白质 |
| C、纤维素 | D、油脂 |
用惰性电极电解2L、1mol/L的CuSO4溶液,在电路中通过0.5mol电子后,调换正、负极,电路中又通过了1mol电子,此时溶液中H+的浓度(假设溶液体积不变)是( )
| A、1.5mol/L |
| B、0.75mol/L |
| C、0.5mol/L |
| D、0.25mol/L |
 ;△H1
;△H1