题目内容
13.下列实验“操作”、“现象”与“结论”对应关系正确的是( )| 选 项 | 操 作 | 现 象 | 结 论 |
| A | 向无水乙醇中滴入酸性KMnO4溶液,充分振荡 | 紫红色褪去 | 乙醇有氧化性 |
| B | 向某溶液中滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
B.能和氯化钡反应生成白色沉淀的离子有银离子、硫酸根离子、碳酸根离子、亚硫酸根离子等;
C.氯气和碘离子反应生成碘,碘溶于四氯化碳溶液呈紫色;
D.铵根离子和稀NaOH溶液反应生成一水合氨,不加热时一水合氨不分解生成氨气.
解答 解:A.酸性高锰酸钾溶液具有强氧化性,乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该实验体现乙醇还原性,故A错误;
B.能和氯化钡反应生成白色沉淀的离子有银离子、硫酸根离子、碳酸根离子、亚硫酸根离子等,所以向某溶液中滴加BaCl2溶液生成白色沉淀不能说明原溶液中含有硫酸根离子,故B错误;
C.氯气和碘离子反应生成碘,碘溶于四氯化碳溶液呈紫色,该实验现象说明原溶液中含有碘离子,故C正确;
D.铵根离子和稀NaOH溶液反应生成一水合氨,不加热时一水合氨不分解生成氨气,该实验中不能说明原溶液中是否含有铵根离子,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、氧化还原反应,明确化学反应原理、物质性质是解本题关键,易错选项是D,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.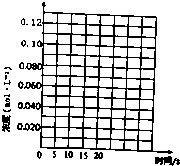 一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
回答下列问题:
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量大,说明反应为放热反应,△H小于0.容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(2)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(3)t分钟后容器III达到平衡,t>20s(填“>”“<”或“=”).判断的理由是甲醇的起始浓度相同,但容器I的温度大于容器III的温度.
请在图中分别画出容器I和容器III中CH3OH(g)浓度变化的曲线示意图.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
 一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量大,说明反应为放热反应,△H小于0.容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(2)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(3)t分钟后容器III达到平衡,t>20s(填“>”“<”或“=”).判断的理由是甲醇的起始浓度相同,但容器I的温度大于容器III的温度.
请在图中分别画出容器I和容器III中CH3OH(g)浓度变化的曲线示意图.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
5.实验中的下列操作正确的是( )
| A. | 进行蒸馏操作时冷凝管进水的方向是上进下出 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
2.下列有关研究物质性质的方法和程序的说法中,不正确的是( )
| A. | 研究物质的性质时,常用到观察、实验、分类、比较、模型、假设等方法 | |
| B. | 研究物质性质的一般程序的第二步是观察物质的外观 | |
| C. | 可以用分类的方法预测物质的性质 | |
| D. | 观察是一种有计划、有目的地用感官考察研究对象的方法 |
3.室温下将a mL三种一元酸分别和NaOH溶液等体积混合,实验数据如表:
(1)上述这三种酸中一定属于强酸的是HY,丙组实验发生反应的离子方程式为HZ+OH-═H2O+Z-,所得溶液中由水电离出的c(OH-)=mol•L-1.
(2)部分实验反应过程中的pH变化曲线如图:

①表示乙组实验的pH变化曲线是图1(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是BE.
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L
②c(OH-)=1.0×10-3 mol•L-1的氨水c L
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.则a、b、c、d的大小关系是b>a=d>c.
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图3中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1 <m2(填“<”、“=”、“>”)
| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |
(2)部分实验反应过程中的pH变化曲线如图:

①表示乙组实验的pH变化曲线是图1(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是BE.
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L
②c(OH-)=1.0×10-3 mol•L-1的氨水c L
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.则a、b、c、d的大小关系是b>a=d>c.
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图3中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1 <m2(填“<”、“=”、“>”)
