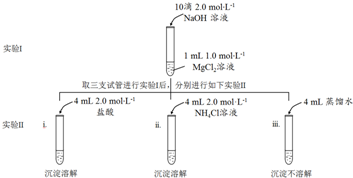
题目内容
14.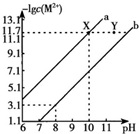 25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )| A. | b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1 | |
| B. | 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中C(Fe2+):C(Cu2+)=1:104.6 | |
| C. | 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 | |
| D. | 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
分析 A.该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则c(Fe2+)>c(Cu2+),离子浓度越大,-lgC(M2+)值越小;
B.C(Fe2+):C(Cu2+)=$\frac{Ks[Fe(OH)_{2}]}{Ksp[Cu(OH)_{2}]}$;
C.向X点对应的饱和溶液中加入少量NaOH,金属离子的浓度会减小;
D.除去CuSO4溶液中含有的少量Fe2+,加入适量CuO,Fe2+不变.
解答 解:A.该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则c(Fe2+)>c(Cu2+),离子浓度越大,-lgC(M2+)值越小,则相同条件下,饱和溶液中C(Fe2+)较大,所以Fe(OH)2饱和溶液中-lgC(Fe2+)较小,则b线表示Fe(OH)2饱和溶液中的变化关系,由图象可知,pH=8时,-lgC(Fe2+)=3.1,Ksp[Fe(OH)2]=10-3.1×(10-6)2=10-15.1,故A正确;
B.当pH=10时,-lgC(Cu2+)=11.7,则Ksp[Cu(OH)2]=10-11.7×(10-4)2=10-19.7,C(Fe2+):C(Cu2+)=$\frac{Ks[Fe(OH)_{2}]}{Ksp[Cu(OH)_{2}]}$=$\frac{1{0}^{-15.1}}{1{0}^{-19.7}}$=$\frac{1}{1{0}^{-4.6}}$,故B错误;
C.向X点对应的饱和溶液中加入少量NaOH,溶液中会生成Cu(OH)2沉淀,溶液中铜离子的浓度会减小,而从X点到Y点铜离子浓度不变,故C错误;
D.Ksp[Cu(OH)2]<Ksp[Fe(OH)2],Cu(OH)2更易生成沉淀,在含有Fe2+的CuSO4溶液中,加入适量CuO,不能生成Fe(OH)2沉淀,所以Fe2+浓度不变,故D错误.
故选A.
点评 本题考查了难溶物的溶解平衡、溶度积的表达式及计算、物质的分离与提纯,题目难度中等,注意掌握难溶物的溶解平衡及其影响因素,明确溶度积的概念及计算方法.

| A. | 在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小 | |
| B. | 在ZnSO4溶液中各离子的浓度关系为:2c(Zn2+)+c(H+)═c(OH-)+2c(SO42-) | |
| C. | 在0.5 L 0.10 mol•L-1的ZnSO4溶液中加入等体积的0.02 mol•L-1的AgNO3溶液,即可生成Ag2SO4沉淀 | |
| D. | 常温下,要除去0.20 mol•L-1 ZnSO4溶液中的Zn2+,至少要调节pH≥8 |
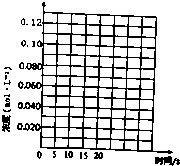 一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量大,说明反应为放热反应,△H小于0.容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(2)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(3)t分钟后容器III达到平衡,t>20s(填“>”“<”或“=”).判断的理由是甲醇的起始浓度相同,但容器I的温度大于容器III的温度.
请在图中分别画出容器I和容器III中CH3OH(g)浓度变化的曲线示意图.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )