题目内容
浓度为0.01mol/L的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有c(H+)( )
| A、0.05mol/L |
| B、0.001mol/L |
| C、0.002mol/L |
| D、0.005mol/L |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:溶液在稀释前后溶质的物质的量不变,对于稀释后的溶液取出10mL,浓度与稀释后溶液的浓度相同.
解答:
解:设稀释到2VmL时溶液的浓度为x,
根据溶液在稀前后溶质的物质的量不变,
则0.01mol?L-1×VmL×10-3L=x×2VmL×10-3L,
解得x=0.005mol/L,
取出10mL溶液的浓度与稀释后溶液的浓度相同,
则c(H+)=c(HCl)=0.005mol/L,
故选D.
根据溶液在稀前后溶质的物质的量不变,
则0.01mol?L-1×VmL×10-3L=x×2VmL×10-3L,
解得x=0.005mol/L,
取出10mL溶液的浓度与稀释后溶液的浓度相同,
则c(H+)=c(HCl)=0.005mol/L,
故选D.
点评:本题考查物质的量浓度的有关计算,明确稀释前后溶质的物质的量不变时解答本题的关键,并能利用物质的构成来分析离子的浓度.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、1mol NaHSO4晶体含有2NA个离子 |
| B、1L2mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA个 |
| C、1mol CH3+(碳正离子)中含有的电子数为10NA |
| D、在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA |
下列离子方程式正确的是( )
| A、向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ |
| B、FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- |
| D、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
下列说法正确的是( )
| A、14C与12C互为同素异形体 |
| B、乙醇、乙酸和甲醛广泛应用于食品加工 |
| C、纤维素、合成纤维、光导纤维都是有机高分子化合物 |
| D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
固体X只可能由Al、(NH4)2SO4,MgCl2,FeCl2,AlCl3,AgN03中的一种或几种组成,某同学对该固体进行了如下实验:
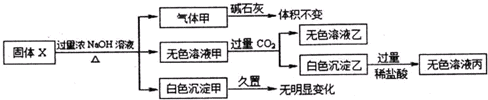
下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯挣物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 |
| D、将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 |
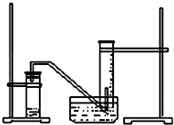 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?