题目内容
下列离子方程式正确的是( )
| A、向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ |
| B、FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- |
| D、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.BaCl2与SO2不反应;
B.Cl2与FeBr2反应先氧化亚铁离子,再氧化溴离子;
C.碳酸钠溶液与硫酸铝反应生成氢氧化铝和二氧化碳;
D.Ba(OH)2和NaHSO4等物质的量反应生成硫酸钡、氢氧化钠和水.
B.Cl2与FeBr2反应先氧化亚铁离子,再氧化溴离子;
C.碳酸钠溶液与硫酸铝反应生成氢氧化铝和二氧化碳;
D.Ba(OH)2和NaHSO4等物质的量反应生成硫酸钡、氢氧化钠和水.
解答:
解:A.向BaCl2溶液中通入SO2气体,二氧化硫与水反应生成亚硫酸是弱酸,如果与BaCl2反应其产物是强酸盐酸和亚硫酸钡,实际上该反应不能发生,故A错误;
B.Cl2与FeBr2反应先氧化亚铁离子,再氧化溴离子,FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B错误;
C.碳酸钠溶液与硫酸铝反应生成氢氧化铝和二氧化碳,其反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故C错误;
D.Ba(OH)2和NaHSO4等物质的量反应生成硫酸钡、氢氧化钠和水,其反应的离子方程式为:Ba2++SO42-+H++OH-=BaSO4↓+H2O,故D正确.
故选D.
B.Cl2与FeBr2反应先氧化亚铁离子,再氧化溴离子,FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B错误;
C.碳酸钠溶液与硫酸铝反应生成氢氧化铝和二氧化碳,其反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故C错误;
D.Ba(OH)2和NaHSO4等物质的量反应生成硫酸钡、氢氧化钠和水,其反应的离子方程式为:Ba2++SO42-+H++OH-=BaSO4↓+H2O,故D正确.
故选D.
点评:本题考查离子方程式的书写,明确物质的溶解性、物质的性质及离子方程式书写规则即可解答,题目难度不大,注意反应物的用量不同时方程式可能不同.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2012年,将在京津冀、长三角、珠三角等重点区域以及直辖市和省会城市开展PM2.5(PM2.5是指大气中直径接近于2.5×10 -6m的颗粒物)和臭氧监测,下列有关说法正确的是( )
| A、PM2.5在空气中形成了气溶胶 |
| B、同温同压条件下,等质量的氧气和臭氧体积比为2:3 |
| C、16g臭氧中含有NA个原子 |
| D、1.00 mol臭氧中含有电子总数为18NA |
设NA表示阿伏加德罗常数的值.下列有关说法正确的是( )
| A、在标准状况下,2.24L氮气含有共用电子对数的0.5NA |
| B、22.4g铁粉完全溶于一定浓度的硝酸中,转移的电子数可能为0.6NA |
| C、4.6g甲醇和二甲醚(CH3-O-CH3)的混合物中所含分子数等于0.1NA |
| D、含Al3+数目为0.1NA的硝酸铝溶液中,NO3-个数大于0.3NA |
同质量的下列气体中,所含原子数最少的是( )
| A、CH4 |
| B、CO2 |
| C、HCl |
| D、N2 |
浓度为0.01mol/L的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有c(H+)( )
| A、0.05mol/L |
| B、0.001mol/L |
| C、0.002mol/L |
| D、0.005mol/L |
能正确表示下列反应的离子方程式为( )
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、Mg(HCO3)2溶液与过量NaOH:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- |
| D、次氯酸钙与亚硫酸:Ca2++2ClO-+H2SO3=CaSO3↓+2HClO |

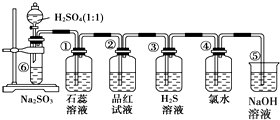 如图是实验室制备SO2并验证SO2某些性质的装置图,试回答:
如图是实验室制备SO2并验证SO2某些性质的装置图,试回答: