题目内容
广口瓶简单,但它的用途真不简单!实验室用Zn粒和盐酸反应制得的H2,其中含酸雾、水汽、硫化氢及少量氧气等杂质气体,某同学仅用四只广口瓶设计了以下几种装置,按一定顺序连接,便达到了当气体通过时,每一装置除去一种气体的目的.
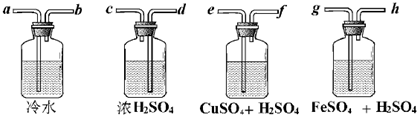
(1)它们连接的顺序为 ;
(2)除去H2S的离子方程式为 ;
(3)除去O 2的离子方程式为 ,观察到的现象为 .

(1)它们连接的顺序为
(2)除去H2S的离子方程式为
(3)除去O 2的离子方程式为
考点:实验装置综合
专题:实验设计题
分析:(1)每一装置除去一种气体,应先除去氯化氢酸雾,然后用硫酸铜除去硫化氢,再用硫酸亚铁除去氧气,最后用浓硫酸干燥;
(2)硫化氢能和硫酸铜反应生成硫化铜沉淀和硫酸;
(3)氧气能将亚铁离子氧化到正三价,从而消耗氧气.
(2)硫化氢能和硫酸铜反应生成硫化铜沉淀和硫酸;
(3)氧气能将亚铁离子氧化到正三价,从而消耗氧气.
解答:
解:(1)氢气的酸雾即氯化氢气体极易溶于水,可以用冷水吸收,硫化氢气体可以和硫酸铜反应生成沉淀,用硫酸铜来吸收,氧气可以将硫酸亚铁氧化,用硫酸亚铁来除去,水可以用浓硫酸来吸收,作为洗气装置,导管一定要长进短出,水的除去一定要放在最后,其他气体的除去先后可以颠倒,连接顺序是:a→b→e→f→g→h→d→c,故答案为:a→b→e→f→g→h→d→c;
(2)硫酸铜和硫化氢反应的实质是:Cu2++H2S=CuS↓+2H+,故答案为:Cu2++H2S=CuS↓+2H+;
(3)氧气可以将硫酸亚铁氧化,用硫酸亚铁来除去,氧气氧化亚铁离子的实质是:4Fe2++O2+4H+=4Fe3++2H2O,现象是:装有FeSO4和H2SO4溶液的广口瓶中溶液的颜色由浅绿色变成棕黄色,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;装有FeSO4和H2SO4溶液的广口瓶中溶液的颜色由浅绿色变成棕黄色.
(2)硫酸铜和硫化氢反应的实质是:Cu2++H2S=CuS↓+2H+,故答案为:Cu2++H2S=CuS↓+2H+;
(3)氧气可以将硫酸亚铁氧化,用硫酸亚铁来除去,氧气氧化亚铁离子的实质是:4Fe2++O2+4H+=4Fe3++2H2O,现象是:装有FeSO4和H2SO4溶液的广口瓶中溶液的颜色由浅绿色变成棕黄色,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;装有FeSO4和H2SO4溶液的广口瓶中溶液的颜色由浅绿色变成棕黄色.
点评:本题考查物质的分离、提纯的实验设计,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,为解答该题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
浓度为0.01mol/L的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有c(H+)( )
| A、0.05mol/L |
| B、0.001mol/L |
| C、0.002mol/L |
| D、0.005mol/L |
2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示下列判断中,正确的是( )
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | |
| A、乙中SO2的平衡转化率大于80% |
| B、该温度下,乙达平衡时间小于甲 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率大于乙中O2的转化率 |
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、混合酸中NO3-物质的量为2mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、混合酸中H2SO4 的物质的量的浓度为2.5mol |
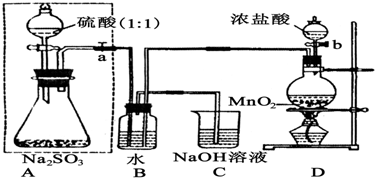
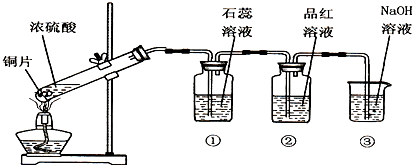
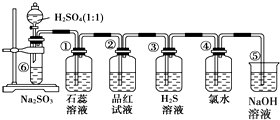 如图是实验室制备SO2并验证SO2某些性质的装置图,试回答:
如图是实验室制备SO2并验证SO2某些性质的装置图,试回答: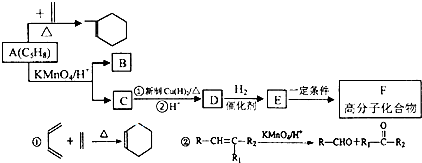
 时,A发生的反应类型为
时,A发生的反应类型为