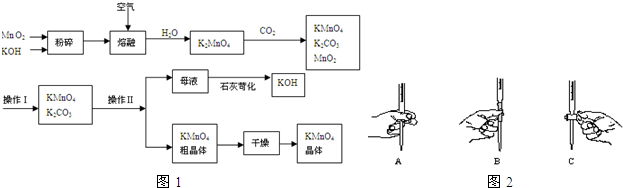
题目内容
12. 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价.(1)铜原子的原子结构示意图:
 ;
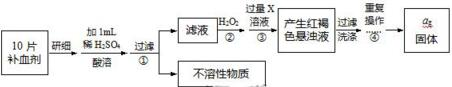
;(2)右图为某铜矿晶体结构单元,该铜矿的化学式为Cu2O.
(3)已知,铜的第一电离能为746kJ•mol-1,第二电离能为1958kJ•mol-1.请结合核外电子排布相关知识解释,铜第二电离能远远大于第一电离能的原因:Cu+中的3d轨道处于全充满状态,较稳定.
(4)对于CuX(X为卤素)而言,铜与X形成的化学键极性越强,对应的CuX的溶解度越大.据此可知,CuCl的溶解度比CuI的溶解度更大(填“更大”或“更小”);
(5)CO、NH3都能提供孤电子对与Cu+形成配合物.Cu+与NH3形成的配合物可表示为[Cu(NH3)n]+.该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对.
①[Cu(NH3)n]+中n=2;
②[Cu(NH3)n]+中Cu+与n个氮原子构成的空间结构呈直线型;
③[Cu(NH3)n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO.加热分解放出CO的过程中,必须克服微粒间的作用力是配位键.
(6)+2价铜的氢氧化物难溶于水,但可溶于浓氨水形成配位数为4的配合物.写出氢氧化铜溶解于浓氨水的离子方程式Cu(OH)2+4NH3.H2O═[Cu(NH3)4]2++2OH-+4H2O.
分析 (1)Cu原子核外29个电子,分四层排布;
(2)利用均摊法计算晶胞;
(3)失去1个电子后,Cu+处于稳定状态,第二电离能较大;
(4)根据Cl与I元素的非金属性强弱比较;
(5)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构;
(6)+2价铜存在空轨道,氨气可提供孤对电子,二者结合可形成配离子而溶解.
解答 解:(1)Cu原子核外29个电子,分四层排布,其电子排布式为: ,故答案为:
,故答案为: ;
;
(2)根据晶胞结构可知,O位于顶点和体心,共有:8×$\frac{1}{8}$+1=2个,Cu位于体心,共4个,n(Cu):n(O)=2:1,所以化学式为Cu2O,
故答案为:Cu2O;
(3)失去1个电子后,Cu+中的3d轨道处于全充满状态,处于稳定状态,第二电离能较大,
故答案为:Cu+中的3d轨道处于全充满状态,较稳定;
(4)Cl的非金属性比I大,铜与Cl形成的化学键极性更强,对应的CuCl的溶解度较大,
故答案为:更大;
(5)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构,则[Cu(NH3)n]+中Cu+与2个氮原子形成配位键,
故答案为:①2;②直线;③配位键;
(6)+2价铜存在空轨道,氨气可提供孤对电子,二者结合可形成配离子而溶解,离子方程式为:Cu(OH)2+4NH3.H2O═[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3.H2O═[Cu(NH3)4]2++2OH-+4H2O.
点评 本题考查较为综合,涉及电子排布式、晶胞计算、电离能、杂化理论的应用以及配合物知识,题目难度中等,本题中易错点为(5),注意配合物知识的分析和积累.

①H2 ②铝 ③SiO2 ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
(3)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(4)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),还原剂与氧化剂的物质的量之比是1:1.
 .第一电离能最小的元素是Cu(填元素符号).
.第一电离能最小的元素是Cu(填元素符号).

 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.