题目内容
4.现有下列九种物质:①H2 ②铝 ③SiO2 ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
(3)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(4)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),还原剂与氧化剂的物质的量之比是1:1.
分析 (1)酸性氧化物是指:氧化物和碱发生反应生成盐和水的氧化物,发生的反应是复分解反应;
物质能够导电,主要存在自由移动的导电粒子即可;
在水溶液和熔融状态下都不导电的化合物为非电解质,在水溶液或熔融状态下能够导电的化合物电解质,据此进行判断;
(2)离子方程式H++OH-═H2O表示可溶性的强酸与可溶性的强碱发生中和反应,生成可溶性的盐,据此写出满足该条件下的化学反应方程式;
(3)少量的④CO2通入⑥Ba(OH)2的溶液中反应,是酸性氧化物和碱的反应生成盐和水,少量二氧化碳和氢氧化钡溶液反应生成碳酸钡沉淀和水;
(4)反应中元素化合价升高的物质失电子做还原剂被氧化,发生氧化反应,元素化合价降低的物质得到电子做氧化剂,被还原发生还原反应.
解答 解:(1)酸性氧化物是指和碱反应生成盐和水的氧化物,③SiO2 和碱反应的化学方程式为:SiO2+2NaOH=Na2SiO3+H2O,④CO2 和碱反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,符合酸性氧化物概念,故选③④;
能够导电,物质中存在自由移动的导电粒子,满足该条件的有:②铝是金属存在自由移动的电子,能导电,⑦氨水是氨气的水溶液,存在自由移动的阴阳离子能导电,⑧稀硝酸是硝酸的水溶液属于强电解质溶液,存在自由移动的阴阳离子能导电,⑨熔融Al2(SO4)3 完全电离存在自由移动的阴阳离子能导电,故选②⑦⑧⑨;
电解质为在水溶液或熔融状态下能够导电的化合物,满足该条件的有:⑤H2SO4 是酸是化合物,水溶液中完全电离出离子,溶液能导电,属于电解质,⑥Ba(OH)2固体是盐属于化合物,溶于水完全电离出离子,能导电属于电解质,⑨熔融Al2(SO4)3是化合物,熔融状态完全电离,存在自由移动的阴阳离子能导电,属于电解质,故选⑤⑥⑨,
故答案为:
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
故答案为:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;
(3)少量的④CO2通入⑥Ba(OH)2的溶液中反应,是酸性氧化物和碱的反应,少量二氧化碳和氢氧化钡溶液反应生成碳酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O,
故答案为:Ba2++2OH-+CO2=BaCO3↓+H2O;
(4)Al+4HNO3═Al(NO3)3+NO↑+2H2O,反应中铝元素化合价升高,0价变化为+3价,失电子做还原剂被氧化,发生氧化反应,氮元素化合价降低,+5价变化为+2价,得到电子做氧化剂,被还原发生还原反应,依据电子守恒可知还原剂与氧化剂的物质的量之比是1:1,
故答案为:HNO3;1:1.
点评 本题考查了物质的导电性、电解质、酸性氧化物的判断,氧化还原反应概念的分析,题目难度中等,注意明确电解质与非电解质的概念、物质导电性的条件,掌握离子方程式的意义及书写方法.


I.已知下列物质的键能:
| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
Ⅱ恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如图1.
(1)图1中0~2s内的反应速率v(H2)=0.75mol/(L.s);该温度下平衡常数的计算表达式为$\frac{(1.00mol/L)^{2}}{(1.5mol/L)^{3}•(1.00mol/L)}$.
(2)该反应达到平衡的标志为AD(填序号).
A.混合气体的平均相对分子质量不变
B.物质的量浓度比等于系数比
C.容器内温度不变
D.断裂1moIH-H键同时断裂2molN-H键
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)增大(填“增大”、“减小”、“不变’’或“不能确定”).
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.
若用
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:①吸附后,能量状态最低的是C(填字母序号).
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;c0后速率降低的原因可能是达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
| A. | 硫酸钠溶液 | B. | AgN03溶液 | C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
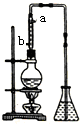 分液.
分液.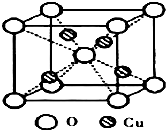 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价. ;
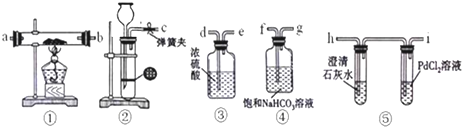
;
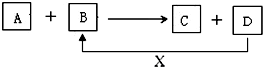 A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:
A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白: