题目内容
7.A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8.请回答:(1)试写出B2单质的电子式为
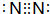 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O.
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色单质,且产物对大气无污染,其化学反应方程式是N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2+2H2O.
(4)在2L的密闭容器中,通入2mol B2气体和3mol A2气体,一定温度下反应生成BA3气体,当反应达到平衡时,A2的浓度为0.15mol•L-1,同时放出约83.2kJ的热量,该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1.
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式2NaN3+2H2O═3N2↑+H2↑+2NaOH;若0.1mol该化合物完全反应,转移电子的物质的量为0.1mol.
分析 A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,为10电子微粒,A和E同主族,则E只能处于第三周期,故B为N元素、C为O元素、D为F元素;原子的最外层电子数的关系为A+D=B+F=8,则A原子最外层电子数为1,F原子最外层电子数为3,则A、E处于IA族,故E为Na,F处于ⅢA族,故F为Al,结合(4)A可以形成A2气体,A为H元素,据此解答.
解答 解:A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,为10电子微粒,A和E同主族,则E只能处于第三周期,故B为N元素、C为O元素、D为F元素;原子的最外层电子数的关系为A+D=B+F=8,则A原子最外层电子数为1,F原子最外层电子数为3,则A、E处于IA族,故E为Na,F处于ⅢA族,故F为Al,结合(4)A可以形成A2气体,A为H元素.
(1)N2单质的电子式: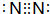 ,由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式为H2O2,故答案为:
,由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式为H2O2,故答案为: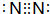 ;H2O2;
;H2O2;
(2)E的最高价氧化物对应水化物为NaOH,向含有Al3+离子的溶液中滴加过量NaOH的溶液,其离子方程式是:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O;
(3)N2H4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,反应生成Cu、氮气与水,化学反应方程式是:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2+2H2O,
故答案为:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2+2H2O;
(4)在2L的密闭容器中,通入2mol N2气体和3mol H2气体,一定温度下反应生成NH3气体,当反应达到平衡时,H2的浓度为0.15mol•L-1,同时放出约83.2kJ的热量,则参加反应氢气为3mol-0.15mol/L×2L=2.7mol,故3mol氢气反应放出的热量为83.2kJ×$\frac{3mol}{2.7mol}$=92.4kJ,该反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1;
(5)化合物NaN3与水可以反应生成两种气体单质和一种碱,应生成氮气、氢气与氢氧化钠,其化学方程式为:2NaN3+2H2O═3N2↑+H2↑+2NaOH,若0.1mol该NaN3完全反应,N元素平均化合价由-$\frac{1}{3}$升高为0价,故转移电子的物质的量为0.1mol×3×$\frac{1}{3}$=0.1mol,
故答案为:2NaN3+2H2O═3N2↑+H2↑+2NaOH;0.1mol.
点评 本题考查元素推断、常用化学用语书写、电子转移计算等,注意掌握常见10电子离子,是对学生综合能力的考查,难度中等.

| A. | H2SO4滴入NaAlO2溶液中 | B. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 | ||
| C. | Al2(SO4)3溶液滴入NaOH溶液中 | D. | 氨水滴入Al2(SO4)3溶液中 |
| A. | 红棕色的NO2气体加压后颜色先变深再变浅 | |
| B. | 打开汽水瓶,看到有大量的气泡逸出 | |
| C. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| D. | H2、I2、HI混合气体加压后颜色变深 |

I.已知下列物质的键能:
| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
Ⅱ恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如图1.
(1)图1中0~2s内的反应速率v(H2)=0.75mol/(L.s);该温度下平衡常数的计算表达式为$\frac{(1.00mol/L)^{2}}{(1.5mol/L)^{3}•(1.00mol/L)}$.
(2)该反应达到平衡的标志为AD(填序号).
A.混合气体的平均相对分子质量不变
B.物质的量浓度比等于系数比
C.容器内温度不变
D.断裂1moIH-H键同时断裂2molN-H键
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)增大(填“增大”、“减小”、“不变’’或“不能确定”).
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.
若用
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:①吸附后,能量状态最低的是C(填字母序号).
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;c0后速率降低的原因可能是达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.
| A. | 上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W) | |
| B. | W和X、Y、Z均能形成18电子的分子 | |
| C. | Y2X和Y2X2中阴、阳离子个数之比均为1:2 | |
| D. | X、Y、Z三种元素形成的化合物,其水溶液一定呈碱性 |
| A. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 | |
| D. |  催化加氢可生成3-甲基己烷 催化加氢可生成3-甲基己烷 |
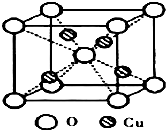 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价. ;
;
 A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:
A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白: