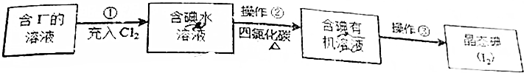
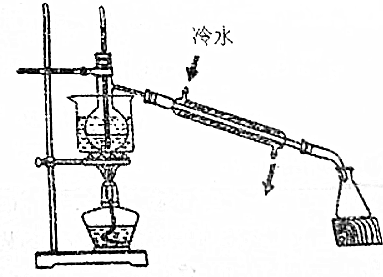
题目内容
1.能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式:①2H2(g)+O2(g)═2H2O(l)△H=-570kJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol;
③C(s)+$\frac{1}{2}$O2(g)═CO (g)△H=-110.5kJ/moL;
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/moL;
⑤CO2(g)+2H2O(g)═2CH4(g)+2O2(g)△H=+890kJ/moL
回答下列问题:
(1)上述反应中属于燃烧热的热化学方程式的是④.
(2)H2的燃烧热为285KJ/mol.
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然难直接测定,但可通过间接的方法求得.试写出碳与水蒸气反应的热化学方程式C(s)+H2O(g)=H2(g)+CO (g)△H=+131.5KJ/mol;该反应的熵△S>0 (选填“>”、“=”、“<”);已知自由能△G可推知该反应在高温条件下可自发进行.
分析 (1)燃烧热的热化学方程式中,可燃物必须为1mol,生成的必须是稳定的氧化物,水必须为液态,据此分析;
(2)燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态;
(3)利用③-②可计算C(s)+H2O(g)=H2(g)+CO (g)的反应热
解答 解:(1)燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,故在燃烧热的热化学方程式中,可燃物必须为1mol,生成的必须是稳定的氧化物,水必须为液态,故④为燃烧热的热化学方程式,故答案为:④;
(2)燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态,故氢气的燃烧热可以通过反应①来得到,但反应①中是2mol氢气燃烧放出570KJ的热量,故氢气的燃烧热为285KJ/mol,故答案为:285KJ/mol;
(3)将③-②可得C(s)+H2O(g)=H2(g)+CO (g)△H=(-110.5kJ/mol)-(-242kJ/mol)=+131.5kJ/mol,该反应吸热即△H>0,由于此反应中气体的种类和分子个数增多,故为熵增的反应,即△S>0,则反应若要能自发进行,应该高温下.
故答案为:C(s)+H2O(g)=H2(g)+CO (g)△H=+131.5KJ/mol;>;高温.
点评 本题考查化学反应与能量变化,为高频考点,注意把握盖斯定律的应用以及反应能否自发进行的判断,结合反应的热化学方程式解答该题,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列有机物实际存在且命名正确的是( )
| A. | 2,2-二甲基丁烷 | B. | 2-甲基-5-乙基-1-己烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 3,3-二甲基-2-戊烯 |
6.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H=-890.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(1)△H=+571.6 kJ/mol | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(g)△H=-1400 kJ/mol |
13.在合成氨反应中:N2+3H2?2NH3经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用V(H2)表示反应速率为V(H2)=0.45mol/(L•S),则这段时间为( )
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
11.NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
| A. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 常温常压,完全燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | |
| C. | 所含共用电子对数目为($\frac{a}{7+1}$)NA | |
| D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
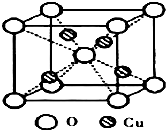 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价. ;
;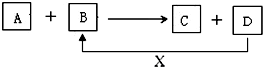 A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:
A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白: