题目内容
7.下列实验方案可行的是( )| A. | 用萃取的方法分离汽油和煤油 | |
| B. | 用NaOH溶液除去二氧化碳中的一氧化碳气体 | |
| C. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 | |
| D. | 要鉴别水中是否有氯离子,可加入AgNO3溶液,观察是否产生白色沉淀 |
分析 A.汽油和煤油互溶;
B.一氧化碳与氢氧化钠溶液不反应;
C.镁粉和铁粉可与盐酸反应;
D.生成的沉淀不一定为AgCl.
解答 解:A.汽油和煤油互溶,不能用萃取的方法分离,但二者的沸点不同,可用蒸馏的方法,故A错误;
B.一氧化碳与氢氧化钠溶液不反应,但二氧化碳反应,应用灼热的CuO除杂,故B错误;
C.镁粉和铁粉可与盐酸反应,但铜不反应,可用盐酸除杂,故C正确;
D.加入AgNO3溶液,生成的沉淀不一定为AgCl,应先加入硝酸酸化,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的检验、混合物分离提纯,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | 常温常压下,7.8 gNa2O2含有的Na+数为0.2NA | |
| B. | 标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA | |
| C. | 标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L | |
| D. | 50℃、1×105Pa下6g NO2与0℃、2×105 Pa下46 g N2O4均含有3NA个原子 |
15.下列说法不正确的是( )
| A. | 有机物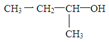 的名称为2-丁醇 的名称为2-丁醇 | |
| B. | 蛋白质、淀粉、纤维素都是高分子化合物 | |
| C. | 合成有机物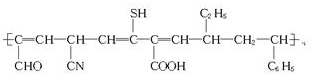 使用的单体有3种 使用的单体有3种 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同 |
12.已知X、Y是主族元素,I为电离能,单位是kJ•mol-1.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 780 | 1300 | 2100 | 11600 |
| A. | 若元素Y处于第三周期,它可与冷水剧烈反应 | |
| B. | 元素X的常见化合价是+1 | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 元素X与氯形成化合物时,化学式可能是XCl |
19.乙苯的二氯代物共有( )
| A. | 6种 | B. | 9种 | C. | 12种 | D. | 15种 |
16.有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧聚乙炔.其中既能使酸性KMnO4溶液褪色,也能与溴水反应而使溴水褪色的是( )
| A. | ②③⑤ | B. | ②③⑦ | C. | ②③⑧ | D. | ②③⑦⑧ |
17.根据原子结构及元索周期律的知识,下列叙述正确的是( )
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 由子F元素的最低化合价为-1价,故F元素的最高化合价为+7价 | |
| C. | 硅处于金属与非金属的过渡位置,故硅可用作半导体材枓 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
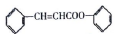 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示: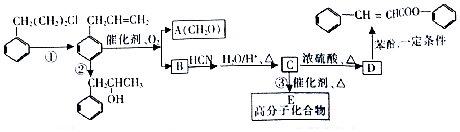
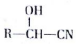 $→_{△}^{H_{2}O/H+}$
$→_{△}^{H_{2}O/H+}$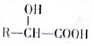
 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +nH2O.
+nH2O. (任写一种).
(任写一种).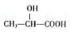 )的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)
)的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)