题目内容
12.已知X、Y是主族元素,I为电离能,单位是kJ•mol-1.请根据下表所列数据判断,错误的是( )| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 780 | 1300 | 2100 | 11600 |
| A. | 若元素Y处于第三周期,它可与冷水剧烈反应 | |
| B. | 元素X的常见化合价是+1 | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 元素X与氯形成化合物时,化学式可能是XCl |
分析 X、Y是主族元素,I为电离能,X第一电离能和第二电离能差距较大,说明X为第IA族元素;
Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,X的第一电离能小于Y,说明X的金属活泼性大于Y,以此解答该题.
解答 解:A.若元素Y处于第3周期,为Al元素,它不能与冷水剧烈反应,但能溶于酸和强碱溶液,故A错误;
B.X为第IA族元素,元素最高化合价与其族序数相等,所以X常见化合价为+1价,故B正确;
C.通过以上分析知,Y为第IIIA族元素,故C正确;
D.元素X与氯形成化合物时,X的电负性小于Cl元素,所以在二者形成的化合物中X显+1价、Cl元素显-1价,则化学式可能是XCl,故D正确.
故选A.
点评 本题考查元素电离能和原子结构关系,为高考常见题型和高频考点,侧重考查学生的分析能力,正确推断元素在周期表中的位置是解本题关系,灵活运用基本概念、基本理论结合物质结构、性质解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.SF6是一种优良的绝缘气体,分子结构中只存在S-F键.已知:断裂1mol F-F键、S-F键需吸收的能量分别为160kJ、330kJ.在反应:S(s)+3F2(g)═SF6(g)中,若生成1mol SF6(g)时,放出1220kJ的能量,则1mol S(s)转化为S(g)时吸收的能量为( )
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
20. 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )| A. | 该反应的平衡常数表达式为:K=$\frac{{C}_{(C)}}{{{C}^{2}}_{(A)}•{C}_{(B)}}$ | |
| B. | 0~4 min时,A的平均反应速率为0.01 mol/(L•min) | |
| C. | 由T1向T2变化时,v正>v逆 | |
| D. | 平衡后升高温度,K值增大 |
7.下列实验方案可行的是( )
| A. | 用萃取的方法分离汽油和煤油 | |
| B. | 用NaOH溶液除去二氧化碳中的一氧化碳气体 | |
| C. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 | |
| D. | 要鉴别水中是否有氯离子,可加入AgNO3溶液,观察是否产生白色沉淀 |
17.用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ②⑤⑥ |
4.从樟科植物枝叶提取的精油中含有一种有机物 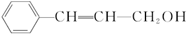 ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )
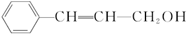 ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )| A. | 能使溴水、酸性高锰酸钾溶液褪色 | |
| B. | 分子中所有原子在同一平面内 | |
| C. | 分子式为C9H12O | |
| D. | 能发生加成反应、酯化反应、水解反应 |
2.在含有元素硒(Se) 的保健品已经开始进入市场,已知它与氧元素同族,与钾元素同周期,关于硒的说法中正确的是( )
| A. | Se的原子序数为 24 | |
| B. | Se的氢化物的还原性比硫化氢气体强 | |
| C. | Se的非金属性比Br强 | |
| D. | Se的最高价氧化物分子式为:SeO2 |