题目内容
17.根据原子结构及元索周期律的知识,下列叙述正确的是( )| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 由子F元素的最低化合价为-1价,故F元素的最高化合价为+7价 | |
| C. | 硅处于金属与非金属的过渡位置,故硅可用作半导体材枓 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
分析 A.酸性的强弱与H原子的个数无关;
B.F无正价;
C.硅处于金属与非金属的过渡位置,为可导电的非金属;
D.具有相同的核外电子排布的离子,核电荷数越大离子半径越小.
解答 解:A.H2SO4、HClO4都为最高价氧化物的水化物,酸性的强弱与非金属性的强弱有关,非金属性越强,酸性越强,与H原子的个数无关,故A错误;
B.F的非金属性最强,无正价,故B错误;
C.硅处于金属与非金属的过渡位置,为可导电的非金属,可用作半导体材枓,故C正确;
D.具有相同的核外电子排布的离子,核电荷数越大离子半径越小,应为S2-、Cl-、K+、Ca2+半径逐渐减小,故D错误.
故选C.
点评 本题考查元素周期律知识,为高考常见题型,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
7.下列实验方案可行的是( )
| A. | 用萃取的方法分离汽油和煤油 | |
| B. | 用NaOH溶液除去二氧化碳中的一氧化碳气体 | |
| C. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 | |
| D. | 要鉴别水中是否有氯离子,可加入AgNO3溶液,观察是否产生白色沉淀 |
8.下列化学用语表示正确的是( )
| A. | 羟基的电子式: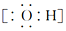 | B. | 乙酸的分子式:CH3COOH | ||
| C. | 溴乙烷的结构简式:CH2BrCH2Br | D. | 乙炔的实验式:CH |
5.下列说法正确的是( )
| A. | 元素的种类由最外层电子数决定 | |
| B. | 化学键是存在于分子、原子和离子间的作用力 | |
| C. | 原子的种类由原子核内质子数与中子数共同决定 | |
| D. | 化学反应速率可以决定反应的限度 |
12.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述不正确的是( )
| A. | W、X、Y、Z最外层电子数之和为20 | B. | WX2、YX2和ZX2均只含共价键 | ||
| C. | 原子半径的大小顺序为X<W<Y<Z | D. | Z的气态氢化物比Y的稳定 |
2.在含有元素硒(Se) 的保健品已经开始进入市场,已知它与氧元素同族,与钾元素同周期,关于硒的说法中正确的是( )
| A. | Se的原子序数为 24 | |
| B. | Se的氢化物的还原性比硫化氢气体强 | |
| C. | Se的非金属性比Br强 | |
| D. | Se的最高价氧化物分子式为:SeO2 |
1. 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
①由表中数据判断△H<0(填“>”、“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4 mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4 mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
 ,则下列物质与
,则下列物质与  互为同分异构体的是( )
互为同分异构体的是( )



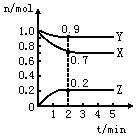 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.