题目内容
15.下列有关说法中正确的是( )| A. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
分析 A.某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,可知c(H+)=c(OH-);
B.由水电离出的c(H+)=10-12mol•L-1的溶液,为酸或碱溶液;
C.结合Ksp计算需要的银离子,需要银离子浓度小的阴离子先沉淀;
D.pH=7,可知c(H+)=c(OH-),结合电荷守恒式c(Na+)+c(H+)=c(OH-)+c(CH3COO-)分析.
解答 解:A.某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,可知c(H+)=c(OH-),则溶液为中性,故A正确;
B.由水电离出的c(H+)=10-12mol•L-1的溶液,为酸或碱溶液,酸碱溶液中均不能大量存在HCO3-,故B错误;
C.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,由Ksp可知需要银离子浓度分别为$\frac{1.56×1{0}^{-10}}{0.01}$=1.56×10-8mol/L、$\frac{9.0×1{0}^{-12}}{(0.01)^{2}}$=9.0×10-8mol/L,则Cl-先产生沉淀,故C错误;
D.pH=7,可知c(H+)=c(OH-),由c(Na+)+c(H+)=c(OH-)+c(CH3COO-)可知,c(Na+)=c(CH3COO-),故D错误;
故选A.
点评 本题考查难溶电解质及酸碱混合,为高频考点,把握溶液酸碱性判断、离子浓度关系、Ksp的计算为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
18.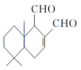 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )| A. | H2 | B. | Cu(OH)2悬浊液 | C. | HBr | D. | Br2的CCl4溶液 |
6.下列有关推断中,不正确的是( )
| 事 实 | 结 论 | |
| A | CaCO3+2CH3COOH=(CH3COO)2Ca+CO2↑+H2O | 酸性:CH3COOH>H2CO3 |
| B | 氢硫酸(H2S)放置在空气中变浑浊 | 氧化性:O2>S |
| C | Al(OH)3既溶于强酸又溶于强碱 | Al元素既有金属性也有非金属性 |
| D | 反应A+2B?C达平衡后,升高温度平衡正向移动 | 升高温度,使v正增大、v逆减小 |
| A. | A | B. | B | C. | C | D. | D |
3.可确认发生了化学平衡移动的是( )
| A. | 化学反应速率发生了改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 某一条件的改变,使正、逆反应速率不再相等 | |
| D. | 可逆反应达到平衡,使用了催化剂 |
10.下列离子方程式书写正确的是( )
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ | |
| C. | 氢氧化钠溶液吸收足量SO2气体:SO2+2OH-═SO32-+H2O | |
| D. | 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- |
20.化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况.下列反应中属于这种情况的是( )
①过量的锌与18mol/L的硫酸反应
②浓盐酸与过量的MnO2
③过量铜与浓硫酸
④过量稀硝酸与银反应
⑤过量稀硫酸与块状石灰石.
①过量的锌与18mol/L的硫酸反应
②浓盐酸与过量的MnO2
③过量铜与浓硫酸
④过量稀硝酸与银反应
⑤过量稀硫酸与块状石灰石.
| A. | ②③⑤ | B. | ②④ | C. | ①③④ | D. | ①②③④⑤ |
7.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 1 mol甲烷燃烧生成气态水和二氧化碳气体所放出的热量就是甲烷的燃烧热 | |
| C. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
4.下列表示可燃物燃烧热的热化学方程式是( )
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-802.3 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 |