题目内容
3.可确认发生了化学平衡移动的是( )| A. | 化学反应速率发生了改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 某一条件的改变,使正、逆反应速率不再相等 | |
| D. | 可逆反应达到平衡,使用了催化剂 |
分析 可根据化学平衡移动的因素以及可以反应的类型来综合分析,一定条件下,当改变其中一个条件,平衡向减弱这种改变的方向进行;
A、正逆反应速率同等程度改变,平衡不动;
B、反应前后气体物质的量不变的反应,压强变、平衡不移动;
C、正逆反应速率不等,则平衡一定发生移动;
D、催化剂改变反应速率不改变化学平衡.
解答 解:A..化学反应速率发生改变,未必能说明化学平衡发生了移动,当正反应速率与逆反应速率仍然相等时,化学平衡不会发生移动;当正反应速率与逆反应速率不相等时,化学平衡就会发生移动,故A错误;
B.对于气体总体积反应前后不变的可逆反应来说,压强改变,平衡不移动,故B错误;
C.正逆反应速率不等,则平衡一定发生移动,故C正确;
D.催化剂只能同等程度地改变正反应速率和逆反应速率,当一个可逆反应建立化学平衡状态后,加入催化剂,正反应速率仍然等于逆反应速率,化学平衡不会发生移动,故D错误;
故选C.
点评 本题要求要能灵活运用影响化学平衡的因素来分思考问题,是对基础知识灵活运用的考查,要求学习时一定要记住并能深刻理解,题目较简单.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
11.NA代表阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 常温常压下,2.24 L SO2与O2混合气体中所含氧原子数小于0.2NA | |
| B. | 点解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| C. | 常温下,1 L pH=13的Ba(OH)2中含有的OH-数目为0.2NA | |
| D. | 10 mL 98%的H2SO4溶液,加入水中稀释至100 mL,H2SO4的质量分数为9.8% |
18.下列说法正确的是( )
| A. | 1molOH-的质量是17g | B. | 1mol气体所占的体积等于22.4L | ||
| C. | 氢气的摩尔质量是2g | D. | 摩尔是物质的质量单位 |
8.FeS2与HNO3反应后的氧化产物为Fe(NO3)3和H2SO4,若反应中FeS2与HNO3的物质的量之比为1:8,则HNO3的还原产物为( )
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
15.下列有关说法中正确的是( )
| A. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
13. 把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )
把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )
 把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )
把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )| A. | a的取值范围为0≤a<50 | |
| B. | 当a=30时,$\frac{n(Mg)}{n(Al)}$=1 | |
| C. | 图中0~a段,与NaOH发生反应的微粒是H+ | |
| D. | 当v(NaOH)=90mL时,溶液中的溶质为NaAlO2 |
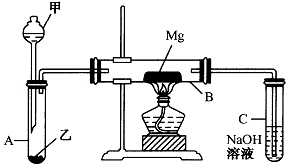 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.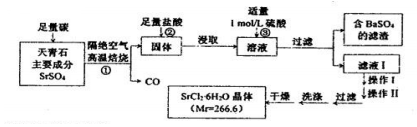
 ;
;