题目内容
10.下列离子方程式书写正确的是( )| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ | |
| C. | 氢氧化钠溶液吸收足量SO2气体:SO2+2OH-═SO32-+H2O | |
| D. | 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- |
分析 A.氢氧化钠过量,离子方程式按照碳酸氢钙的化学式组成书写;
B.硫酸根离子恰好沉淀时,NH4Al(SO4)2与氢氧化钡按照物质的量1:2反应,氢氧化铝溶解前铵根离子先结合氢氧根离子,反应生成一水合氨和氢氧化铝沉淀;
C.二氧化硫足量,反应生成亚硫酸氢根离子;
D.标准状况下,1.12LCO2气体的物质的量为0.05mol,1L 0.1mol/L的NaAlO2溶液中含0.1molNaAlO2,所以CO2少量反应生成碳酸盐.
解答 解:A.向饱和碳酸氢钙溶液中加入过量的NaOH溶液,反应生成碳酸钙沉淀、碳酸钠和水,正确的离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故A错误;
B.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓,故B正确;
C.氢氧化钠溶液吸收足量SO2气体,反应生成亚硫酸氢钠,正确的离子方程式为:SO2+OH-═HSO3-,故C错误;
D.标准状况下,1.12LCO2气体的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,1L 0.1mol/L的NaAlO2溶液中含有偏铝酸钠的物质的量为:0.1mol/L×1L=0.1mol,所以将二者混合后CO2少量,反应生成碳酸盐,正确的离子方程式为:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32-,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

| A. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时:4OH-+3SO2=SO32-+2HSO3-+H2O | |
| B. | 向含1mol的NaOH溶液中通入1mol的H2S气体:H2S+2OH-=S2-+2H2O | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 1mol/L的NaAlO2溶液和2.5mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
该反应方程式的配平化学计量数是( )
| A. | 1,8,4,1,4 | B. | 2,16,5,2,8 | C. | 1,6,5,1,3 | D. | 1,8,5,1,4 |
| A. | 1molOH-的质量是17g | B. | 1mol气体所占的体积等于22.4L | ||
| C. | 氢气的摩尔质量是2g | D. | 摩尔是物质的质量单位 |
| A. | 1 mol氦气中有2NA个氦原子 | |
| B. | 14 g氮气中含6.02×1023个氮原子 | |
| C. | 2 L 0.3 mol•L-1 Na2SO4溶液中含0.6 NA个Na+ | |
| D. | 18 g水中所含的电子数为10NA |
| A. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |




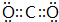 ,BA2分子中化学键属于共价键.
,BA2分子中化学键属于共价键.